(12分)由几种盐溶于水中形成的一瓶澄清的溶液,其中可能含有NH4+、Na+、Mg2+、Ba 2+、Al3+、Fe3+、C
2+、Al3+、Fe3+、C u2+、Cl-、Br-、I-、NO3-、CO32-、SO32-、SO42-中的几种。取该溶液进行以下实验:
u2+、Cl-、Br-、I-、NO3-、CO32-、SO32-、SO42-中的几种。取该溶液进行以下实验:
(1)用pH试纸检验,pH试纸呈红色。排除 离子的存在。
(2)取出部分溶液,加入少量CCl4及几滴新制氯水,经振荡CCl4层呈紫红色。排除
离子存在。
(3)另取部分溶液,逐渐向其中加入NaOH溶液,使溶液从酸性逐渐变为碱性,在滴加过程中和滴加完毕后,均无沉淀产生。则可排除 离子的存在。
离子的存在。
(4)另取部分上述碱性溶液,向其中加入Na2CO3溶液,有白色沉淀生成。证明
离子存在,又排除 离子存在。
(5)根据上述实验事实能否确定NH4+是否存在,若能,请简述理由 ,若不能,请简述检验它的方法 。
(6)原溶液一定存在的离子有 ,不能确定的离子有 。
(10分)已知:溴单质(Br2)、化合物与氯的性质相似,溴单质的水溶液呈黄色,溴单质的四氯化碳溶液呈橙红色。在足量的稀氯化亚铁溶液中,加入1~2滴液态溴单质,振荡后溶液变为黄色。
⑴甲同学认为这不是发生化学反应所致,使溶液变黄色的物质是 (填化学式,下同);乙同学认为这是发生化学反应所致,使溶液变黄色的物质是 。
⑵现提供如下试剂:
| A.酸性高锰酸钾溶液 | B.氢氧化钠溶液 | C.四氯化碳 | D.硫氰化钾溶液 |
实验证明乙同学的推断是正确的,请用三种方法加以验证,写出选用的试剂编号及实验中观察到的现象:
| 选用试剂(代号) |
实验现象 |
|
| 第一种方法 |
||
| 第二种方法 |
||
| 第三种方法 |
⑶根据上述实验推测,若在稀溴化亚铁溶液中通入氯气,首先被氧化的离子是 。
(4分) 将下列各分离物质方法的编号,填在各小题末的括号内:
A. 过滤法; B降温结晶法; C. 分液法; D. 萃取分液法;
E. 蒸馏法; F. 层析法; G. 升华法
(1)将天然水制为纯净水()(2)除去植物油中的水()
(3)将溶液中的硝酸钾与氯化钠分离()(4)除去食盐水中的泥沙()
某学生在实验室测定一未知浓度的稀盐酸,已知在25ml氢氧化钠标准溶液中逐滴加入0.2mol/L醋酸溶液的PH变化曲线如图所示:
(1)该氢氧化钠溶液的物质的量浓度为mol.L—1
(2)在B点,a12.5ml(填“>”、“<”或“="”" )。
(3)配制100 mL NaOH标准溶液所需仪器除托盘天平、玻璃棒、胶头滴管外,还需要
(4)用量取20.00 mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用NaOH标准溶液进行滴定。为了减小实验误差,该同学一共进行了三次实验,假设每次所取稀盐酸体积均为20.00 mL,三次实验结果记录如下:
| 实验次数 |
第一次 |
第二次 |
第三次 |
| 消耗NaOH溶液体积/mL |
19.00 |
23.00 |
23.02 |
该盐酸的浓度约为___________________ (保留两位有效数字)。
滴定达到终点的标志是
欲用浓硝酸法测定某铜银合金中铜的质量分数(测定反应后生成气体的量),但资料表明:①反应中除生成NO2气体外还有少量NO生成;②常温下NO2和N2O4混合存在,在低于0℃时,几乎只有无色的N2O4液体或晶体存在。为完成测定并验证确有NO生成,有人设计了如图所示的实验装置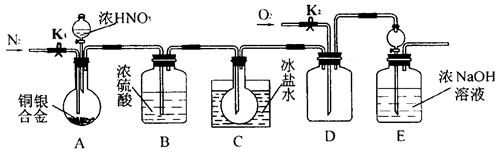
(1)实验开始前要先打开A部分的活塞K1,持续通一段时间的氮气再关闭K1,这样做的目的是___。
(2)装置中B瓶的作用是。
(3)A中的反应停止后,打开D中的活塞K2,并通入氧气,若反应确有NO产生,则D中应出现的现象是____。
(4)为减少测量误差,在A中反应完成和D中出现现象后,还应继续进行的操作是。
(5)C装置烧瓶中的物质是,用简单的实验证实你的判断:。
(6)实验已测出一定质量的铜银合金完全反应后E装置的生成物中含氮元素的质量,为确定合金中铜的质量分数还需测定的数据是____________________________。
已知某纯碱(Na2CO3)试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验。
主要实验步骤如下:
①按图组装仪器,并检查装置的气密性;
②将a g试样放人锥形瓶中,加适量蒸馏水溶解,得到试样溶液;
③称量盛有碱石灰的U型管的质量,得到b g;
④从分液漏斗滴人6 mol·L-1的硫酸,直到不再产生气体时为止;
⑤从导管A处缓缓鼓人一定量的空气;
⑥再次称量盛有碱石灰的U型管的质量,得到c g;
⑦重复步骤⑤和⑥的操作,直到U型管的质量基本不变,为d g;
请填空和回答问题:
(1)在用托盘天平称量样品时,如果天平的指针向左偏转,说明
(2)装置中干燥管B的作用是
(3)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果将(填偏高、偏低或不变)
(4)步骤⑤的目的是
(5)步骤⑦的目的是
(6)该试样中纯碱的质量分数的计算式为