已知下列热化学方程式:
①CaCO3(s)===CaO+CO2(g) ΔH=177.7 kJ
②C(s)+H2O(s)===CO(g)+H2(g) ΔH=-131.3 kJ/mol
③H2SO4(l)+NaOH(l)===Na2SO4(l)+H2O(l) ΔH=-57.3 kJ/mol
④C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ/mol
⑤CO(g)+O2(g)===CO2(g) ΔH=-283 kJ/mol
⑥HNO3(aq)+NaOH(aq)===NaNO3(aq)+H2O(l) ΔH=-57.3 kJ/mol
⑦2H2(g)+O2(g)===2H2O(l) ΔH=-517.6 kJ/mol
(1)上述热化学方程式中,不正确的有______________,不正确的理由分别是________
(2)根据上述信息,写出C转化为CO的热化学方程式: 。
(3)上述反应中,表示燃烧热的热化学方程式有 ;
表示中和热的热化学方程式有______________。
 A物质为重要的有机化合物,可以发生如下所示的一系列反应。
A物质为重要的有机化合物,可以发生如下所示的一系列反应。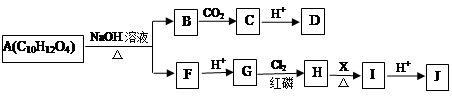
已知:①A分子中苯环上有两个对位的取代基;可以与碳酸氢钠反应生成二氧化碳。
②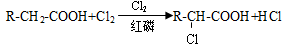
③F的分子式为C3H5O2Na。
请回答下列问题:
(1)可选用__________(填试剂名称)检验C物质中的官能团;D的结构简式为________。
(2)I分子结构中含有碳碳双键,则试剂X为________。
(3)J可以发生的反应类型有__________(填序号)
a.消去反应 b.酯化反应 c.加聚反应 d.缩聚反应
(4)A与足量NaOH水溶液反应的化学方程式为_______________________。
(5)K满足以下条件,则K的结构简式为_______________。
①与A物质为同系物,且比A分子少一个C原子;
②苯环上两个取代基在对位,能与银氨溶液发生银镜反应;
③相同物质的量的K和A与NaOH溶液反应,消耗NaOH的量相同。
镍、钴、铈、铬虽然不是中学阶段常见的金属元素,但在工业生产中有着重要的作用。
(1)二氧化铈 (CeO2)是一种重要的稀土氧化物,在平板电视显示屏中有着重要的应用。CeO2在稀硫酸和H2O2的作用下可生成Ce3+,H2O2在该反应中作_____(填“氧化”“还原”)剂,每有1mol H2O2参加反应,转移电子的物质的量为_____。
(2)某锂离子电池含Li+导电固体为电解质。充电时,Li+还原为Li,并以原子形式嵌入电极材料碳(C6)中,以LiC6表示,电池反应为LiCoO2+ C6 CoO2+LiC6。则放电时,电池的正极反应式为________________,如图表示该装置工作时电子和离子的移动方向,此时该电池处于_________(填“放电”或“充电”)状态。
CoO2+LiC6。则放电时,电池的正极反应式为________________,如图表示该装置工作时电子和离子的移动方向,此时该电池处于_________(填“放电”或“充电”)状态。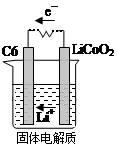
(3)自然界Cr主要以三价Cr和六价Cr的形式存在。六价Cr能引起细胞的突变和癌变。可以用亚硫酸钠将其还原为三价铬,完成并配平下列离子方程式:__Cr2O72-+__SO32-+__H+=__Cr3++__SO42-+ __ ____
(4)NiSO4·6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有Cu、Zn、Fe等元素)为原料获得。操作步骤如下: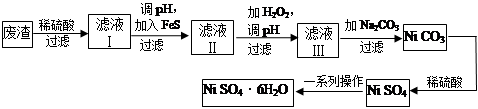
向滤液Ⅰ中加入FeS主要目的是除去Cu、Zn等杂质,除去Cu2+的离子方程式为______________________。
②向滤液Ⅱ中加入H2O2,溶液中发生反应的离子方程式为__________________,调节pH的目的是______________________。
③滤液Ⅲ溶质的主要成分是NiSO4,再加入碳酸钠过滤后,加稀硫酸溶解又生成NiSO4的目的是______________________。
④我国第五套人民币中的一元硬币材料为钢芯镀镍,镀镍时,镍应作_____极。
平衡是化学反应原理中的重要内容。按要求回答下列问题:
(1)已知:2SO2(g)+O2(g) 2SO3(g) ΔH1平衡常数为K1
2SO3(g) ΔH1平衡常数为K1
2NO(g)+O2(g) 2NO2(g)ΔH2平衡常数为K2
2NO2(g)ΔH2平衡常数为K2
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH="______" (用ΔH 1和ΔH 2表示);此反应该温度下的平衡常数K=______(用K1和K2表示)。
SO3(g)+NO(g)的ΔH="______" (用ΔH 1和ΔH 2表示);此反应该温度下的平衡常数K=______(用K1和K2表示)。
(2)已知A(g)+B(g)  C(g)+D(g),该反应在3L密闭容器中,在两种不同的条件下进行反应,A、B的起始物质的是分别为3.0mol和6.0mol,其中实验I的条件为T1℃。A的物质的量随时间的变化如图所示。
C(g)+D(g),该反应在3L密闭容器中,在两种不同的条件下进行反应,A、B的起始物质的是分别为3.0mol和6.0mol,其中实验I的条件为T1℃。A的物质的量随时间的变化如图所示。
①实验Ⅱ可能改变的条件是_______________。
②T1℃时该反应的平衡常数为_____(用分数表示),达到平衡时,A的反应速率为____。
(3)已知HCN溶液的电离平衡常数Ka=10-5mol•L-1,c平衡(HCN)≈c起始(HCN),水的电离可不计,则此温度下0.1 mol•L-1的HCN溶液的pH=_________。
(4)对于0.1mol•L-1 Na2CO3溶液,该溶液中离子浓度由大到小的顺序是______,向该溶液中加水稀释的过程中,c(H2CO3)逐渐____(填“增大”“不变”或“减小”, 下同) ,c(H2CO3)/ c(CO32-)逐渐______。
已知A为淡黄色固体,T、R为两种常见的用途很广的金属单质,D是具有磁性的黑色晶体,C是无色无味的气体,H是白色沉淀。推断A—W物质各是什么,回答下列问题。
(1)写出下列物质的化学式:D:N:。
(2)A和水的反应属于下列何种反应类型(填序号)。
A.化合反应 B.氧化还原反应 C.离子反应 D.置换反应
(3)若要确定E溶液中是否含有W物质,所选试剂为(填序号)。
A.氯水和KSCN溶液 B.KSCN溶液
C.浓氨水 D.酸性高锰酸钾溶液
(4)B与E混和得到H并在潮湿空气中变成M的过程中,可能观察到的现象:;
(5)B和R反应生成N的离子方程式:;
M→W的离子方程式:;
(1)将一定量的Fe粉、Cu粉、FeCl3溶液、CuCl2溶液混合于某容器中充分反应(假定容器不参与反应),判断下列情况下容器中金属离子与金属单质的存在情况:(用符号表示)
①若Fe粉有剩余,则容器中不可能有____________;
②若FeCl3有剩余,则容器中不可能有___________;
③若CuCl2有剩余,则容器中还可能有____________。
(2)有一瓶无色澄清溶液,可能含NH4+、K+、Na +、Mg2+、Ba2+、 Al3+、 Fe3+、SO42-、CO32-、Cl-、I-中的一种或几种,取该溶液进行如下实验:
①用pH试纸检验,表明溶液呈酸性;
②取部分溶液,加入少量CCl4及数滴新制的氯水,经振荡后静置,CCl4层呈紫红色;
③取部分溶液,逐滴加入稀NaOH溶液,使溶液从酸性逐渐转变为碱性,在滴加过程中及滴加完毕后,溶液中均无沉淀生成;
④取部分上述呈碱性的溶液,加Na2CO3溶液,有白色沉淀生成;
⑤将③得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
根据上述实验事实确定并回答:在溶液中肯定存在的离子有 ,肯定不存在的离子有 ,要确定是否存在的阴离子的实验方法是____________。