下列实验操作或记录正确的是
| A.常温常压下测得1 mol N2的质量为28 g |
B.用量筒测得排水法收集制得的氢气体积为50 .28 mL .28 mL |
| C.用两个250 mL的容量瓶配制0.1 mol/L 500 mL的NaOH溶液 |
| D.用托盘天平称得2.50 g胆矾,受热充分失水后,固体质量减轻0.90 g |
下列反应中,生成物的总能量高于反应物的总能量且属于氧化还原反应的是
| A.Ba(OH)2·8H2O与NH4Cl反应 | B.铝与稀盐酸 |
| C.灼热的炭与CO2反应 | D.甲烷与O2的燃烧反应 |
下列关于化学用语的表述正确的是
A.原子核内有8个中子的碳原子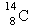 |
B.过氧化氢的电子式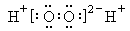 |
| C.HClO的结构式为H—O—Cl |
D.硫原子的原子结构示意图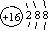 |
元素化学性质发生周期变化性质变化的根本原因是
| A.元素的原子半径呈周期性的变化 |
| B.元素的化合价呈现周期性变化 |
| C.元素原子核外电子排布呈现周期性变化 |
| D.元素的金属性和非金属性呈周期性变化 |
已知反应X+Y=M+N为放热反应,对该反应的下列说法中正确的是
| A.X的能量一定高于M |
| B.Y的能量一定高于N |
| C.X和Y的总能量一定高于M和N的总能量 |
| D.因该反应为放热反应,故不必加热就可发生 |
原子核外每个电子层上均含有2n2个电子的元素是
| A.Be | B.C | C.Ar | D.Ne |