市场上有些食品装在充满气体的塑料袋内,显得鼓鼓的。经询问得知:这样充气的包装,主要是为了使食品能较长时间保鲜、保质和不易压碎。那么,这是什么气体呢?
大明猜想是二氧化碳,小明猜想是氮气。
(1)假设大明的猜想正确,请你用实验方法证明。
(2)假如你是商家,你对食品包装袋中的气体有什么要求呢?
已知M、N分别是稀硫酸、氢氧化钠溶液中的一种。某化学兴趣小组同学在一定量的M中不断滴加N,并测定所得溶液的pH,如图所示。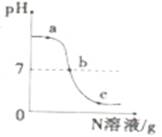
(1)M是(填化学式)。
(2)反应过程中,老师分别取图中a、b、c三处所对应的溶液,打乱顺序后,请同学们用一定的方法将三种溶液加以鉴别(不能用测定溶液pH的方法)。
小明和小红分别取其中一种溶液进行实验:
小明向所取溶液中加入溶液,观察到有蓝色沉淀生成。
结论:是a处溶液。
小红向少量另一种溶液中滴加酚酞溶液,观察到。
结论:是b处或c处溶液。
为进一步确定该溶液成分,小红又设计并完成如下实验:
| 实验步骤 |
实验现象 |
结论 |
| 取少量该溶液,加入适量的 |
___________________ |
为c处溶液,并推知原溶液中的离子有___________(填写离子符号) |
结论:剩余一种为b处溶液。
碳酸钾是农家肥草木灰的主要成分,将它和化肥一起施用,会减少对环境的污染。为了帮助父母合理选择化肥,李明决定对碳酸钾的化学性质进行探究。
【提供信息】钠原子和钾原子的结构示意图分别为:
【实验与探究】李明参照碳酸钠的化学性质设计了如下实验:
【解释与结论】
(1)碳酸钾溶液能使指示剂变色,能与某些酸和反应;
(2)碳酸钾与碳酸钠的化学性质相似;
(3)从微观角度分析,二者化学性质相似的原因是和含有相同的
。
【拓展与应用】李明建议父母最好选择(填字母序号)与草木灰混合施用。
A.
B.
C.
某实验小组的同学利用氢氧化钙溶液和稀盐酸进行酸碱中和反应的实验时,他们在向盛有氢氧化钙溶液的烧杯中滴加一定量的稀盐酸后,才发现忘记滴加了酸碱指示剂,此时,他们停止滴加稀盐酸,并对烧杯内溶液中所含溶质的成分进行探究。
【提出猜想】
猜想一:溶质是
和
猜想二:溶质是
猜想三:溶质是
和。
【查阅资料】
①
溶液呈中性;
②有关的化学反应:
a.氢氧化钙溶液和稀盐酸进行中和反应的化学方程式为:
b.碳酸钠溶液和稀盐酸反应的化学方程式为:
c.碳酸钠溶液和氯化钙溶液反应的化学方程式为:
【实验设计与验证】
(1)小猛同学设计用无色酚酞溶液验证"猜想一"是否成立。取少量上述实验中烧杯里的溶液于试管中,并向试管中滴加几滴无色酚酞溶液,振荡,观察到溶液不变色。于是可以确定"猜想一"(填"成立"或"不成立"),其理由是。
(2)小华同学设计用碳酸钠溶液验证"猜想二"和"猜想三"是否成立。取少量上述实验中烧杯里的溶液于试管中,并向试管中逐滴加入过量的碳酸钠溶液,观察到的现象是:先出现气泡,后有生成。于是可以确定成立。
【交流与反思】
经过同学们讨论和交流,发现只需用下列一种物质就能验证得出以上三种猜想中的哪一种猜想成立,请在下列物质的选项中选择出你认为合理的物质是(填序号)
A.锌粒 B.紫色石蕊溶液 C.二氧化碳
玲玲在学习复分解反应时,对复分解反应的条件产生了兴趣,于是她和小组内的同学仅用以下药品展开了探究活动.
实验药品:稀硫酸、稀盐酸、氢氧化钠溶液、碳酸钠溶液、硝酸钡溶液、氯化钠溶液、酚酞溶液
【提出问题】他们要探究的问题是.
【查阅资料】硝酸钡溶液显中性,且
有毒.
【实验探究】玲玲用上述物质做了下列几组实验
【记录和解释】
(1)组合①、②、⑤均无明显现象,其中组合与另外两组的实质不同.为证明该不同之处,玲玲在实验过程中使用了酚酞溶液.
(2)请写出组合③的化学方程式.
【实验结论】他们请教老师并讨论后知道,只有当两种化合物互相交换成分,生成物中有沉淀或生成时,复分解反应才可以发生.
【拓展延伸】实验结束后,他们将所有废液收集在废液缸中静置,观察到白色沉淀和无色的上层清液.为了确定沉淀和清液的成分,继续展开探究.
【实验1】探究沉淀的成分.
【提出猜想】Ⅰ.沉淀只有硫酸钡;Ⅱ.沉淀只有碳酸钡;Ⅲ.沉淀中含有硫酸钡和碳酸钡
梅梅取少量沉淀于试管中,滴加(请补充完整实验操作和观察到的现象),证明了猜想Ⅲ是正确的.
【实验2】探究清液的成分。
①取少量清液于试管中,向其中滴加几滴硝酸钡溶液,无明显现象.
②另取少量清液于另一只试管中,滴加几滴,有白色沉淀产生.
【解释与结论】探究活动结束后,小组内成员通过讨论分析,一致认为清液中含有的离子是(指示剂除外).
【处理废液】为了防止污染环境,玲玲向废液缸中加入适量的,对废液进行处理后,将固体回收进一步处理,溶液排放.
【交流与反思】根据你对物质溶解性的了解,结合复分解反应发生的条件,请写出一种在水溶液中一般不能发生复分解反应的可溶性盐(写化学式).
在一次化学实验中,同学们将饱和硫酸铜溶液逐滴加到5mL饱和氢氧化钠溶液中,观察到以下异常实验现象:
| 实验序号 |
滴加
溶液的量 |
实验现象 |
| ① |
第1~6滴 |
产生蓝色沉淀,但震荡后沉淀消失,形成亮蓝色溶液 |
| ② |
第7~9滴 |
产生蓝色沉淀,且沉淀逐渐增多,振荡后沉淀不消失,很快沉淀逐渐变黑色 |
在实验①中同学们根据所学初中化学知识判断蓝色沉淀是氢氧化铜,请你写出生成蓝色沉淀的化学方程式。
实验①中蓝色沉淀为什么消失?同学们继续进行如下探究。
【查阅资料】
I.氢氧化铜在室温下温度,70℃-80℃时可脱水分解生成氧化铜
II.铜酸钠[
]溶于水,溶液呈亮蓝色。
【猜想与讨论】
小陶认为蓝色沉淀消失可能是氢氧化铜发生了分解。其他同学一致否定了他的猜测,理由是。
同学们交流讨论后,提出以下两种猜想。
猜想一:少许氢氧化铜可溶于足量水中。
猜想二:氢氧化铜可在足量氢氧化钠浓溶液中溶解,溶液呈亮蓝色。
【实验探究】
为验证猜想,同学们用氢氧化铜粉末(其它试剂可任选)设计如下实验。请你填写表中的空格。
| 实验序号 |
实验方法与操作 |
实验现象 |
结论 |
| ③ |
将少许
粉末加到5mL蒸馏水中,充分振荡 |
猜想一错误 |
|
| ④ |
猜想二正确 |
【结论与反思】
(1)根据实验,并进一步查阅资料知道,氢氧化铜在氢氧化钠溶液中溶解生成
,反应的化学方程式是。
(2)根据实验可知饱和硫酸铜溶液与饱和氢氧化钠溶液的反应是放热反应,依据的实验现象是。