(12分) 下图所示为血红蛋白和肌红蛋白的活性部分――血红素的结构式。 

血红素的结构式
回答下列问题:
⑴血红素中含有C、H、O、N、Fe五种元素,C、N、O三种元素的第一电离能由小到大的顺序是 ,写出基态Fe原子的核外电子排布式  。
。
⑵血红素中N原子的杂化方式为 ,在右图的方框内用“→”标出 Fe2+的配位键。
Fe2+的配位键。
⑶铁有δ、γ、α三种同素异形体,γ晶体晶胞中所含有的铁原子数为 ,δ、α两种晶胞中铁原子的配位数之比为 。
(9分) 已知在同一碳原子上连有两个羟基的化合物是极不稳定的,它会自动脱去一分子水生成含有羰基的化合物。化合物A为苯的同系物,aLA的蒸汽完全燃烧消耗相同状况下O29aL。关于A的一系列转化关系如图所示。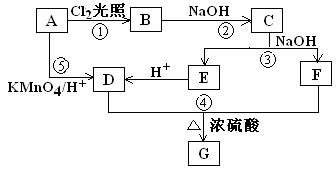
其中C能发生银镜反应,并且C在浓碱条件下可以发生自身氧化还原反应生成E和F。回答有关问题
(1)反应①②③④⑤中,不属于取代反应的有___________________(填序号)。
(2)B是反应①的产物之一,写出反应①的其他可能产物中摩尔质量为195.5g/mol的结构简式__________________。
(3)写出反应④的化学方程式_____________________________________。
(4)G属于芳香酸苯酚酯类的同分异构体有______种,写出其中任意一种的结构简式____________。
(10分)2007年诺贝尔化学奖获得者格哈德·埃特尔建立了合成氨反应机制。T=673K时,各步反应的能量变化如图所示,图中的能量单位为kJ·mol-1(注:图中“吸”表示在催化剂表面的吸附)。请回答下列问题:
(1)合成氨反应的机理为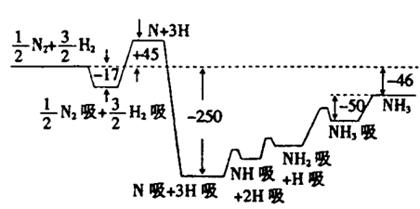
①
②N2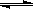 N2吸
N2吸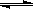 2N
2N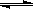 2N吸
2N吸
③N吸+H吸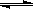 NH吸
NH吸
④NH吸+H吸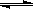 NH2吸
NH2吸
⑤NH2吸+H吸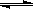 NH3吸
NH3吸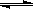 NH3
NH3
(2)T=673K,合成氨反应的热化学方程式为。
(3)液氨和水颇为相像,它能溶解多种无机及有机分子,其电离方程式可表示为2NH3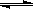
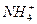 +
+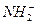 (某温度下其离子积常数为10-30)。液氨中的pNH4与水中的pH相似,则该温度下液氨的pNH4=_________________。
(某温度下其离子积常数为10-30)。液氨中的pNH4与水中的pH相似,则该温度下液氨的pNH4=_________________。
(4)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物。它易溶于水,溶液呈酸性,水解原理与NH4Cl类似。写出盐酸肼第一步水解反应的离子方程式_________________。
(8分)由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)  CH3OH(g)+H2O(g),右下图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。
CH3OH(g)+H2O(g),右下图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。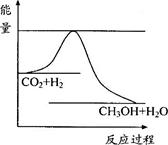
(1)关于该反应的下列说法中,正确的是_______。
A.△H>0,△S>0;B.△H>0,△S<0;
C.△H<0,△S<0;D.△H<0,△S>0。
(2)该反应平衡常数K的表达式为_______________。
(3)温度降低,平衡常数K_____(填“增大”、“不变”或“减小”)。
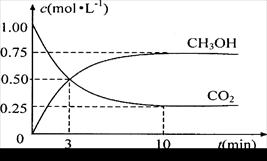
(4)为探究反应原理,现进行如下实验:在体积为2L的密闭容器中,充入2mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化如右图所示。从反应开始到平衡,用氢气浓度变化表示的平均反应速率v(H2) 为:
________________________
(5)下列措施中能使n(CH3OH)/n(CO2)增大的有______。
A.升高温度;B.加入催化剂;
C.将H2O(g)从体系中分离; D.再充入1molCO2和3molH2;
E.充入He(g),使体系总压强增大。
(7分)如下图,E为沾有Na2SO4溶液的滤纸,并加入几滴酚酞。A,B分别为Pt片,压在滤纸两端,R、S为电池的电极。M、N是多微孔的Ni的电极材料,它在碱溶液中可以视为惰性电极。G为电流计,K为开关。C、D和电解池中都充满浓KOH溶液。若在滤纸中央点上一滴紫色的KMnO4溶液,K打开,接通电源一段时间后,C、D中有气体产生。根据图分析回答: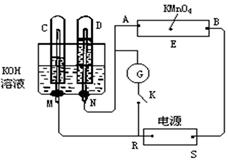
(1)R为____极,S为_____极。
(2)A附近溶液的现象是__________,B附近发生的电极反应式为:
。
(3)滤纸上的紫色点向哪方移动____(填A或B)。
(4)当C、D里的气体产生到一定量时,切断外电源并接通开关K,经过一段时间,C、D中气体逐渐减少,有关的电极反应式为(−)(+)。
(8分)含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液。向其中加入少量酸或碱时,溶液的酸碱性变化不大。
(1)向该溶液中加入少量盐酸时,发生反应的离子方程式是
向其中加入少量KOH溶液时,发生反应的离子方程是
(2)现将0.04 mol·L-1HA溶液和0.02 mol·L-1NaOH 溶液等体积混合,得到缓冲溶液。
①若HA为HCN,该溶液显碱性,则溶液中c(Na+)c(CN−)(填“<”“=”“>”)
②若HA为CH3COOH ,该溶液显酸性。溶液中所有的离子按浓度由大到小排列的顺序是。