图Ⅰ是小红按课本进行的一个化学实验,在实验时同学们闻到了一股
难闻的刺激性气味。于是小明对原实验装置进行了改进,装置如图Ⅱ。
【实验操作】
a.向B、C、E三支试管中分别加入5 mL的蒸馏水,各滴入1~2滴无色酚酞溶液,振荡,观察溶液颜色
b.在A、D试管中分别加入2 mL浓氨水,立即用带橡皮塞的导管按实验图Ⅱ连接好,并将D试管放置在盛有 热水的烧杯中,观察几分钟。
热水的烧杯中,观察几分钟。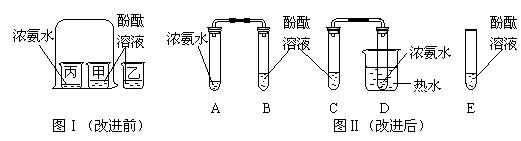
【分析讨论】:
(1)E试管放有酚酞溶液的目的是
(2)进行操作b时观察到的现象是
(3)由此可以得到的有关分子的性质是① ,②
(4)对比改进前的实验,改进后实验的优点是
王老师用自制的花肥给教室里的花施肥时,同学们对这包花肥的成分产生了兴趣。王老师只告诉大家,这种花肥他是用
、
、
、
、
中的几种固体配制而成的。
(1)为确定花肥的成分,小伟同学设计了以下实验,请你与他一起完成。
| 实验 |
实验操作 |
实验现象 |
结论及化学方程式 |
| I |
取少量花肥于试管中,加水溶解,得无色溶液。向其中滴加少量溶液 |
有白色沉淀生成 |
一定有 化学方程式 |
| II |
另取少量花肥于试管中,加水溶解,得无色溶液。向其中滴加适量
溶液 |
一定有 |
(2)小倩同学提出,实验II不能得出相应的结论,还可能含有氯化铵,她的理由是。为此,应该补充的实验是。
| 实验操作 |
实验现象 |
实验结论 |
| 取少量花肥, | 没有 |
(3)通过对以上实验的分析,你认为这包花肥的组成共有种可能。
同学们整理实验室时,发现一瓶敞口放置且失去标签的白色粉末状药品,实验员老师告诉大家原瓶药品可能是碳酸钠、碳酸钙、氯化钠、氢氧化钠中的一种,同学们对此很好奇,于是他们对这瓶白色粉末的成分做了如下探究:
【实验Ⅰ】小明取一定量白色粉末于烧杯中,加水搅拌,充分溶解后,过滤,得到固体和无色溶液.
【实验Ⅱ】小明取实验Ⅰ得到的固体于试管中,滴加足量稀盐酸后,观察到有气泡产生,于是小明马上就得出结论,该瓶中白色粉末一定是碳酸钙,但是小军却认为小明的结论不一定正确,固体还可能是碳酸钠,你认为小军的理由是,请你写出上述有气体生成的反应的化学方程式(任写一个).
小明和小军认为有必要再对实验Ⅰ中滤液的成分进行探究,过程如下:
| 实验步骤 |
实验现象 |
实验结论 |
| (1)取少量滤液于试管中,向其滴加2滴~3滴无色酚酞试液,振荡 |
溶液由无色变为红色 |
该瓶中白色粉末一定不是 |
| (2)另取少量滤液于试管中,滴加过量氯化钙溶液,振荡,静置 |
该瓶中白色粉末一定有碳酸钠,涉及的化学方程式为 |
【反思与交流】实验结束后,同学们通过讨论,一致认为原试剂瓶中的药品也可能不是碳酸钠,你认为他们的理由是.
如图是某化学课外学习小组设计的探究工业炼铁原理及产物验证的实验,其中A装置的作用是将二氧化碳和炭粉在高温下转化为一氧化碳,看图回答下列问题:
(1)写出装置
玻璃管中发生反应的化学方程式:;
(2)实验过程中,应先点燃装置中的酒精喷灯。
(3)要验证
中产生的
,还需要在
之间增加装置(填"
"或"
")。
(4)整套装置还有一个明显的不足之处是:。
(5)由于铁的氧化物
均为黑色,
中得到的铁是否含有
,该小组同学设计了下列探究实验。
【提出问题】
还原
得到的铁是否含有
?
【提出猜想】猜想1:
;猜想2:
;猜想3:
;
猜想4:.
【查阅资料】①
,但
溶液不与
反应
②
③含有
盐溶液遇到
溶液时变成血红色.
【实验探究】限选试剂:
、盐酸、澄清石灰水、
溶液、
溶液
| 实验操作 |
实验现象 |
实验结论 |
| Ⅰ.取少量黑色产物加入到装有FeCl3溶液的烧杯中,充分反应后过滤,对过滤所得固体用蒸馏水洗涤. |
黑色固体部分溶解 |
猜想2和猜想4都不成立 |
| Ⅱ.取第I步洗涤后所得固体加入到装有足量的试管中,充分反应后,再滴加少量KSCN溶液. |
黑色固体全部溶解,溶液不变为血红色 |
|
| Ⅲ.另取少量黑色产物装入玻璃管中,通入CO,一段时间后加热,并将反应后的气体通入装有一定量澄清石灰水的容器中. |
澄清石灰水变浑浊 |
猜想成立 |
(10分)"双吸剂"是一种常见袋装食品的保鲜剂,能吸收空气中的氧气、二氧化碳、水蒸气 等。化学兴趣小组的同学在某食品袋中发现一包"双吸剂",其标签如下图所示。同学们 对这包久置的"双吸剂"固体样品很好奇,设计实验进行探究。
【提出问题】久置"双吸剂"固体的成分是什么?
【查阅资料】
①铁与氯化铁溶液在常温下反应生成氯化亚铁:
;
②碱性的
溶液可以与中性的
溶液发生复分解反应。
【作出猜想】久置固体中可能含有
、
、
、
和
。
【实验探究1】下表是小明设计的实验方案和记录的实验报告,请你补充完整。
| 实验操作 |
实验现象 |
实验结论 |
| ①取少量样品放入试管中,滴加一定量的.用带异營的单孔橡皮塞塞紧试管口,导管另 一端伸入澄清石灰水中。 |
试管中固体逐漸减少, 有大量无色气体产生,得到浅绿色溶液,澄清石灰水变浑浊。 |
样品中一定含有, 不含 。 |
| ②取少量样品放入试管中,加水溶解,静置后取上层清液滴加无色酚酞试液。 |
试管底部有不溶物,上层清液由无色变为红色。 |
样品中含有。 |
【实验质疑】小组同学通过讨论认为实验并不能得出一定不含
的结论,理由是、(用化学方程式表示)。
为进一步确定这包久置的"双吸剂"固体的成分迸行如下定量实验。
【实验探究2】取3g样品研碎,并用磁铁充分吸引后,得到剩余固体2.6g,按照下图流程进行实验,请回答相关问题:
(1)操作二、操作三名称是。
(2)固体I的成分是。(填物质化学式,下同);
(3)烧杯
中溶液和加入的碳酸钠溶液反应的化学方程式为;
(4)依据实验探究1、2中现象的分析及数据计算判断,这包久置"双吸剂"固体的成分是。
【实验反思】
下列对实验探究1、2的反思,不正确的是(填字母序号)。
A.对物质成分的探究有时需要定性与定量实验的结合
B.实验探究2烧杯
中的溶质为
和
C.实验探究1、2中都有气体产生,但生成的气体成分不同
D.在原样品中加人足量盐酸有4个反应发生
实验设计是化学实验的重要环节。请根据下列实验要求回答相关问题: 【活动与探究一】用对比实验方法探究二氧化碳的性质。

(1)实验一中振荡
个矿泉本塑料瓶,观察到塑料瓶变瘪的程度为
,其中变浑浊的瓶内发生反应的化学方程式为;对比
瓶与(填"
"或"
")瓶的实验现象,可证明
能与
发生反应。
(2)实验二观察到
装置中发生的现象是结论是(用化学方程式表示)。
【活动与探究二】用变量控制方法探究影响物质溶解性的因素。
(3)实验三目的是探究对硝酸钾溶解性的影响;实验四是探究溶剂种类对物质溶解性的影响,该实验中需要控制的变量是温度和.
【活动与探究三】定量测定空气中氧气的含量。
(4)实验五中,反应的原理为(用化学方程式表示);装置一比装置二更合理,理由是;
根据下表提供的实验数据,完成下表:
| 硬质玻璃管 的容积 |
反应前注射器中 气体体积 |
反应后注射器中 气体体积 |
实验测得空气中氧气 的体积分数 |
| 30mL |
20mL |
12 mL |
定量实验操作中易产生误差,如果反应前气球中存在气体(其量小于注射器内的空气),而实验后冷却至室温,将气球内的气体全部挤出读数,导致实验测得结果(填"偏小、'偏大"或"无影响")。