有一瓶澄清溶液,可能含有NH4+、K+、Na+、Mg2+、Ba2+、Al3+、Fe3+、Cl-、I-、NO3-、CO32-、SO42-中的一种或几种。取该溶液进行以下实验:
①用pH试纸检验,表明溶液呈强酸性;
②取出部分溶液,加入少量CCl4及数滴新制氯水,经振荡CCl4层呈紫红色;
③另取部分溶液,向其中逐滴加入NaOH溶液,使溶液从酸性变为碱牲,在滴加过程中先生成白色沉淀后完全溶解;取部分碱性溶液加热,有气体放出,该气体能使润湿的红色石蕊试纸变蓝。
④另取部分③中的碱性溶液,向其中加入Na2CO3溶液,有白色沉淀生成。
根据以上实验事实回答下列问题:
(1)该溶液中肯定存在的离子是 ,肯定不存在的离子是 ;
(2)步骤③加入NaOH溶液过程中先生成白色沉淀后完全溶解的离子方程式为 ;
工业废水中常含有一定量的Cr2O72—和CrO42—,它们会对人类及生态系统产生很大的伤害,必须进行处理。该法的工艺流程为
其中第①步存在平衡:2CrO42—(黄色)+2H+ Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O
(1)若平衡体系的pH=2,则溶液显色。
(2)能说明第①步反应达平衡状态的是。(选填编号)
| A.Cr2O72—和CrO42—的浓度相同 | B.v正(Cr2O72—) ="2v" 逆(CrO42—) |
| C.溶液的颜色不变 | D.溶液的pH值不变 |
(3)写出第②步中Cr2O72-转变为Cr3+的离子方程式:。
(4)向Cr2(SO4)3溶液中,滴加NaOH,当pH=4.6时,开始出现Cr(OH)3沉淀,随着pH的升高,沉淀增多,但当pH≥13时,沉淀消失,出现亮绿色的[Cr(OH)4]-离子。其平衡关系如下:
现向0.05mol·L-1的Cr2(SO4)3溶液50mL中,加入等体积0.6 mol·L-1的NaOH溶液,充分反应后,溶液中可观察到的现象为,溶液中离子浓度由大到小的顺序为。
(5)在Na[Cr(OH)4]和Na2Cr2O7混合后的溶液中加入H2SO4酸化,铬元素以形式存在(填写离子符号)。
金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的。难溶金属的氢氧化物在不同pH下的溶解度(S/ mol·L-1)如图所示。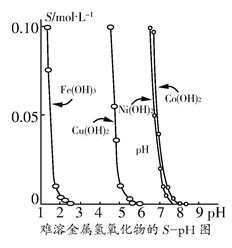
(1)pH=3时溶液中铜元素的主要存在形式是________。
(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH________。
A.<1 B.4左右 C.>6
(3)在Ni(NO3)2溶液中含有少量的Co2+杂质,________(填“能”或“不能”)通过调节溶液pH的方法来除去,理由是__________________________。
(4)要使氢氧化铜沉淀溶解,除了加入酸之外,还可以加入氨水生成[Cu(NH3)4]2+,写出反应的离子方程式:________________________。
(5)已知一些难溶物的溶度积常数如下表:
| 物质 |
FeS |
MnS |
CuS |
| Ksp |
6.3×10-18 |
2.5×10-13 |
1.3×10-35 |
| 物质 |
PbS |
HgS |
ZnS |
| Ksp |
3.4×10-28 |
6.4×10-33 |
1.6×10-24 |
为除去某工业废水中含有的Cu2+、Pb2+、Hg2+杂质,最适宜向此工业废水中加入过量的________。
A.NaOH B.FeS C.Na2S
如图所示,横坐标为溶液的pH值,纵坐标为Zn2+离子或Zn(OH)42—离子物质的量浓度的对数,回答下列问题。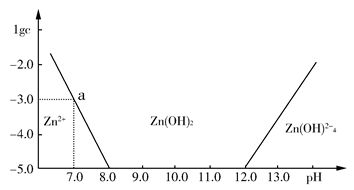
(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为:________。
(2)从图中数据计算可得Zn(OH)2的溶度积(Ksp)=________。
(3)某废液中含Zn2+离子,为提取Zn2+离子可以控制溶液中pH值的范围是________________________。
(4)已知:往ZnCl2溶液中加入硝酸铅或醋酸铅溶液可以制得PbCl2白色晶体;25℃时,PbCl2固体在盐酸中的溶解度如下:
| c(HCl)/( mol·L-1) |
0.50 |
1.00 |
2.04 |
2.90 |
4.02 |
5.16 |
5.78 |
| c(PbCl2)/( mol·L-1)×10-3 |
5.10 |
4.91 |
5.21 |
5.90 |
7.48 |
10.81 |
14.01 |
根据上表数据判断下列说法正确的是________(填字母序号)。
A.随着盐酸浓度的增大,PbCl2固体的溶解度先变小后又变大
B.PbCl2固体在0.50 mol·L-1盐酸中的溶解度小于在纯水中的溶解度
C.PbCl2能与浓盐酸反应生成一种难电离的阴离子(如配合离子)
D.PbCl2固体可溶于饱和食盐水
(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适的氧化剂,使Fe2+被氧化为Fe3+,下列物质可采用的是________。
A.KMnO4 B.H2O2 C.氯水 D.HNO3
然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的________。
A.NaOHB.KOHC.CuO D.Cu(OH)2
(2)甲同学怀疑调整至溶液pH=4不一定能达到除去Fe3+而不损失Cu2+的目的。乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常残留在溶液中的离子浓度小于1×10-5mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为________,Fe3+完全沉淀时溶液的pH为________,通过计算确定上述方案________。(填“可行”或“不可行”)。
已知25°C时:
| 电解质 |
Mg(OH)2 |
Cu(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
| 溶度积 |
1.8×10-11 |
2.2×10-20 |
8.0×10-16 |
4.0×10-38 |
| 完全沉淀时的pH |
9.7 |
5.0 |
5.5 |
4.0 |
在物质的提纯中,常利用难溶电解质的沉淀溶解平衡原理除去某些离子。例如:
①为了除去氯化铵晶体中的氯化铁杂质,先将混合物溶于水,再加入一定量的试剂a进行反应,过滤结晶即可;
②为了除去氯化镁晶体中的氯化铁杂质,先将混合物溶于水,再加入足量的氢氧化镁充分反应,过滤结晶即可;
③为了除去硫酸铜晶体中的硫酸亚铁杂质,先将混合物溶于水,再加入一定量的双氧水,将亚铁离子氧化,然后加入试剂b调节溶液的pH=4,过滤结晶即可。
(1)上述三种除杂方案都将Fe2+、Fe3+转化为________(填化学式)而除去。
(2)试剂a为________。
(3)写出②中除杂所发生的总反应的离子方程式:________。
(4)下列与方案③有关的叙述正确的是________(填字母序号)。
A.H2O2是绿色氧化剂,在氧化过程中不引入杂质,不产生污染
B.将亚铁离子氧化的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH=4的试剂b是氢氧化铜或氧化铜
D.在pH大于4的溶液中Fe3+已完全不存在