下列离子方程式的书写中,正确的是
| A.用氨水吸收少量二氧化硫: NH3·H2O+SO2=NH4++HSO3- |
| B.NH4HCO3溶液与过量NaOH溶液反应: NH4++OH-= NH3↑+H2O |
| C.过量的铁粉与浓硝酸反应: Fe+4H++2NO3—=Fe2++2NO2↑+2H2O |
| D.向漂白粉溶液中通入适量SO2:Ca2++2C1O-+SO2+H2O=CaSO3↓+2HC1O |
通常情况下,既能用浓硫酸干燥,又能用碱石灰干燥的气体是
| A.NH3 | B.Cl2 | C.NO | D.HCl |
下列关于原子的几种描述中,不正确的是
| A.18O与19F具有相同的中子数 | B.16O与18O具有相同的电子数 |
| C.12C与13C具有相同的质量数 | D.15N与14N具有相同的质子数 |
向一定量的Fe、FeO和Fe2O3的混合物中加入120 mL 4 mol/L的稀硝酸,恰好使混合物完全溶解,放出1.344 L NO(标准状况),往所得溶液中加入KSCN溶液无红色出现。若用足量的CO在加热下还原相同质量的混合物,最终得到铁的物质的量为
| A.0.21 mol | B.0.24 mol | C.0.16 mol | D.0.14 mol |
下列示意图与对应的反应情况正确的是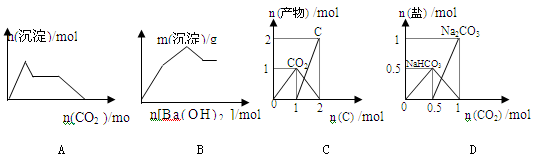
| A.含0.01molKOH 和0.01mol Ca(OH)2的混合溶液中缓慢通入CO2 |
| B.KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液 |
| C.n(O2)=1mol时,高温下C和O2在密闭容器中的反应产物 |
| D.n(NaOH)=1mol时,CO2和NaOH溶液反应生成的盐 |
某研究性学习小组在整理实验室化学试剂时,发现一瓶盛有无色溶液的试剂,标签破损,如图。
某同学根据中学化学知识,对该溶液中的溶质成分进行如下预测和验证,其中错误的是(包括预测物质的化学式、检验需要的试剂、操作、现象及结论)
| 选项 |
预测物质的化学式 |
检验需要的试剂 |
操作、现象及结论 |
| A |
Na2SO4 |
稀盐酸、氯化钡溶液 |
取少量该溶液于试管中,滴入稀盐酸,若无明显现象,再滴入氯化钡溶液,如果产生白色沉淀,则原溶液是Na2SO4溶液 |
| B |
Na2CO3 |
稀盐酸、澄清的石灰水 |
取少量该溶液于试管中,滴入足量稀盐酸,如果产生的无色气体能使澄清的石灰水变浑浊,则原溶液一定是Na2CO3溶液 |
| C |
Na2SO3 |
稀盐酸、澄清的石灰水、品红溶液 |
取少量该溶液于试管中,滴入足量稀盐酸,如果产生的无色气体既能使澄清的石灰水变浑浊,还能使品红溶液褪色,则原溶液是Na2SO3溶液 |
| D |
Na2SiO3 |
过量稀盐酸 |
取少量该溶液于试管中,滴入稀盐酸,产生白色胶状沉淀,盐酸过量时沉淀不溶解,则原溶液是Na2SiO3溶液 |