人通过肺与外界进行气体交换,吸入空气中的氧气,排出二氧化碳和水蒸气。但人体排出的二氧化碳究竟是空气中原有的,还是人体代谢的最终产物,为了证实这个问题,有人采用了右图装置进行实验。
⑴人吸气时,应将活塞A_______(填“打开”或“关闭”),活塞B_______(同上)。
⑵人呼气时,应将活塞A_______,活塞B_______,此时可观察到Ⅱ瓶内的现象是_______。
⑶Ⅰ瓶中所装试剂的作用是_________,Ⅱ瓶中所装试剂的作用是___________。
⑷将上述操作反复进行,能证明人呼出的气体中含有的二氧化碳不是来自于______,而是来自于_____________。
某同学家中有一袋化肥,可能混入了其他化肥,且化肥包装袋上的字迹模糊.该同学进行了如下探究,请你参与探究并填空:
[提出问题]该化肥中含有什么物质?
[收集信息]经询问得知,该化肥为铵态氮肥.
[提出猜想]该化肥所含的阴离子可能是Cl-、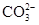 、
、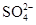 ;中的一种或几种.
;中的一种或几种.
[实验、记录与分析]
| 实验操作步骤 |
实验现象 |
实验分析 |
| (1)取少量该化肥样品和少量熟石灰放在研钵中混合研磨 |
________ |
含有铵根离子 |
| (2)另取少量该化肥样品于试管中,加入适量的水完全溶解,滴加足量的硝酸钡溶液,再滴加少量稀硝酸,过滤 |
产生白色沉淀,沉淀不溶解 |
没有________(填化学式)存在 |
| (3)取(2)中所得滤液少量于试管中,滴加________ |
________ |
有Cl-存在 |
[实验结论]若该化肥中只含有一种阳离子,则其中一定含有的物质是(写化学式)________________________________________________________________________.
[实验反思]若步骤(2)中用氯化钡溶液代替硝酸钡溶液是否可行?________(填“是”或“否”),请简要说明原因:________________________________________.
实验室有一瓶化肥的标签已脱落,只知道它是NH4Cl、(NH4)2SO4、NH4HCO3和尿素[CO(NH2)2]中的一种.请你完成以下探究:
[猜想]猜想①:该化肥是NH4Cl,
猜想②:该化肥是________,
猜想③:该化肥是NH4HCO3,
猜想④:该化肥是尿素.
[实验探究]
(1)取少量样品在研钵中与熟石灰研磨,有刺激性气味的气体放出,证明猜想________不成立;写出其中一种化肥发生该反应的化学方程式:
________________________________________________________________________.
(2)如图1,另取少量样品于试管中,滴加适量水振荡,再选图2中________滴入试管中,若无气泡放出,则猜想________不成立.
(3)在步骤(2)的试管中再滴入图2中的________,若________,则猜想①成立;若________,则猜想②成立,其反应的化学方程式为________________________________________
________________________________________________________________________.
无土栽培是利用营养液栽培作物的一种方法.
(1)下列化学肥料中属于复合肥的是________(填序号).
①硝酸铵
②磷酸二氢铵
③硝酸钾
④硫酸钾
(2)某同学要在实验室配制150g溶质质量分数为2%的硝酸钾溶液,需要硝酸钾的质量为________g.
(3)现有一种无色的营养液,可能由KNO3、Ca(NO3)2、K2CO3、KCl中的一种或几种物质组成,为探究其成分,某同学设计并完成了如下图所示的实验.
根据以上实验,请你进行有关推断.
①由实验1可确定原营养液中一定没有的物质是________________;
②根据实验1、实验2推测原营养液的组成可能有________种情况;
③若测得原营养液中K+和Cl-的数目之比为1︰1,则原营养液的组成中的溶质是________
________________________________________________________________________.
反思、归纳与提升是化学学习的重要方法.
对于复分解反应及其规律,通过反恩与探索,同学们有了新的认识.请填写下文中横线上的空白.
[知识回顾]
(1)氯化氢气体、氢氧化钠固体不导电.
(2)盐酸、氢氧化钠溶液能导电.
[分析归纳]
氯化氢溶于水:HCl H++Cl-
H++Cl-
氢氧化钠溶于水:NaOH Na++OH-
Na++OH-
结论:溶液导电是由于溶液中存在自由移动的离子.
[迁移运用]硫酸钠溶液能导电,原因是硫酸钠溶于水:Na2SO4 ________.
________.
[探索发现]
(1)氢氧化钠溶液与盐酸反应的微观示意图
[分析归纳]
反应的化学方程式:________________________.
反应的实质:H++OH- H2O,反应能进行的原因是溶液中H+和OH-的数目减少,即自由移动的离子数目减少.
H2O,反应能进行的原因是溶液中H+和OH-的数目减少,即自由移动的离子数目减少.
(2)硫酸钠溶液跟氯化钡溶液反应的微观示意图: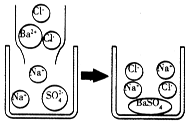
[分析归纳]
反应的化学方程式:________________________.
反应的实质:略.
反应能进行的原因是溶液中________________________的数目减少,即自由移动的离子数目减少.
(提示:该反应有硫酸钡白色沉淀生成)
(3)有气体生成的复分解反应,以Na2CO3+2HCl=2NaCl+H2O+CO2↑为例,反应实质:2H++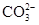
 ________.
________.
[总结规律]
上述复分解反应能发生的本质原因是________________________________________
________________________________________________________________________.
碳酸氢钠是一种重要的盐类物质,在生活中用途广泛.小滨同学设计了实验,以探究碳酸氢钠的化学性质.
[探究实验1]碳酸氢钠溶液的酸碱性
[实验方案1]取少量该固体加入试管中,加适量水溶解,再滴入几滴酚酞溶液,振荡.
现象:溶液变成浅红色.由此得出结论________________________________________
________________________________________________________________________.
[探究实验2]能与酸反应
[实验方案2]取少量该固体加入试管中,滴加稀盐酸,现象为________________________________.
[探究实验3]碳酸氢钠的热稳定性
[实验方案3]用下图所示装置进行实验
现象:充分加热后,大试管口有水珠出现,管底有白色固体残留,小试管中澄清石灰水变浑浊.
结论:碳酸氢钠受热能生成二氧化碳、水和一种白色固体.
验证:(1)请你帮小滨设计实验,证明试管中留下的白色固体是Na2CO3,而不是NaOH(所选试剂不能用酸).
步骤:________________________________________________________________________.
现象:________________________________________________________________________.
(2)碳酸氢钠受热分解的化学方程式________.
[拓展应用]试说出碳酸氢钠在日常生活中的一种用途________________________________.