Ⅰ、氮元素是重要的非金属元素,可形成卤化物、氮化物,叠氮化物及配合物等多种化合物。
(1)NF3,NBr3、NCl3这三种分子的空间构型是 。
(2)叠氮酸(HN3)是一种弱酸,可部分电离出H+和N3-。请写出两种与N3-电子数相等的分子 。
(3)NaN3与KN3离子键强弱相比,NaN3 KN3(填“>”、“=”或“<” )。
(4)氮化碳结构如下图, 其硬度超过金刚石晶体,成为首屈一指的超硬新材料。
①写出氮化碳的化学式____ _ _____;
②指出氮化碳的晶体类型______ _____。
Ⅱ、分析表中四种物质的相关数 据,请回答:
据,请回答:
| |
CH4 |
SiH4 |
NH3 |
PH3 |
| 沸点/K |
101.7 |
161.2 |
239.7 |
185.4 |
| 分解温度/K |
873 |
773 |
1073 |
713.2 |
(1)CH4和SiH4比较,沸点高低的原因是____ _______;
(2)NH3和PH3比较,分 解温度高低的原因是_____ ______;
解温度高低的原因是_____ ______;
(3)结合上述数据和规律判 断,一定压强下HF和HCl的混合气体降温时___________先液化。
断,一定压强下HF和HCl的混合气体降温时___________先液化。
(1)属于人体生命必需微量元素的是__________。(填”Fe”、”H”或 “Na”);
(2)乙烯经加聚反应生成的聚乙烯的结构简式是
_________________________。
(3)钢铁暴露在潮湿空气中发生电化学腐蚀的实质:钢铁表面的水膜与铁组成无数微小的______________________________。
已知某条件下,1molN2(气态)与适量H2(气态)完全反应后生成 NH3(气态),放出92.2 kJ的热量,请写出该反应的热化学方程式:
______________ __________________________________________________
__________________________________________________
现有下列四种物质:①NH4Cl、②Cl2、 ③FeCl3、④NO。其中,能够与氢氧化钙加热条件下反应生成能使湿润的红色石蕊试纸变蓝的气体的是(填序号,下同),遇到KSCN溶液能变红的是,易与空气中氧气反应的是,通常状况下呈黄绿色的是。
③FeCl3、④NO。其中,能够与氢氧化钙加热条件下反应生成能使湿润的红色石蕊试纸变蓝的气体的是(填序号,下同),遇到KSCN溶液能变红的是,易与空气中氧气反应的是,通常状况下呈黄绿色的是。
在Cu+ 4 HNO3(浓)= Cu(NO3)2 + 2NO2↑ + 2 H2O的反应中,作为氧化剂的物质是(填化学式),发生了氧化反应的物质是(填化学式);若反应中生成了 1 mol NO2,则需消耗mol浓HNO3。
随着人们日常生活水平的提高,室内空气污染越来越受到人们的重视。造成室内环境污染的有毒物质主要有甲醛、苯、氨、氡、一氧化碳等物质。
请回答下列问题:
⑴苯分子的结构简式为。
⑵我国《室内空气质量标准》规定室内空气中甲醛(HCHO)含量不得超过0.08mg/m3。某校化学研究性学习小组的同学通过查阅资料,拟采用如下方法测定某新装修居室内空气中甲醛的含量。
测定原理:5HCHO+4KMnO4+6H2SO4=2K2SO4+4MnSO4+5CO2↑+11H2O
实验操作:用容积为1000mL的医用注射器抽取空气,缓慢注入酸性高锰酸钾溶液中(装置如下),当酸性高锰酸钾溶液正好褪色时,停止注入。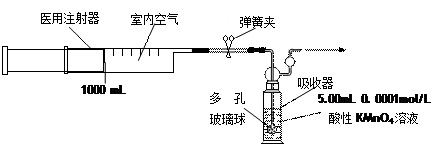
①用0.1000mol/L的酸性KMnO4溶液配制实验中使用的酸性KMnO4溶液1000mL,需0.1000mol/L的酸性KMnO4溶液的体积为。
②向酸性高锰酸钾溶液中注入空气前,应检查吸收器装置气密性,操作方法为;装置中多孔玻璃球的作用是。
③实验时在居室内不同地点抽取空气,并缓慢注入酸性高锰酸钾溶液中。当第200次将注射器中空气全部缓慢注入酸性高锰酸钾溶液中时,酸性高锰酸钾溶液正好褪色。请通过计算说明该居室空气中甲醛含量是否超标(空气中其他成分不与酸性高锰酸钾溶液反应)。
④请你举出减少室内空气污染的一条合理措施:。