20.有关物质存在如下图所示的转化关系(部分产物已省略)。通常C为气体单质,G为紫黑色固体单质.实验室中,常用固体E在B的催化下加热制取气体单质H。
请回答下列问题;
(1)反应①的化学方程式为 ;
(2)反应②的离子方程式为 ;
(3)写出另外一种实验室制取H的化学方程式 ;
(4)D溶液与Pb(NO3)2溶液混合可形成沉淀.此沉淀的Ksp=7.1×10-9mol·L-3.将0.01 mol·L-1的D溶液与0.001 mol·L-1的Pb(NO3)2溶液等体积混合,你认为能否形成沉淀 (填“能”或“不能”),请通过计算说明 。
二氧化硅晶体中,每个Si原子周围结合个O原子;同时,每个O原子跟个Si原子相结合。实际上,SiO2晶体是由Si原子和O原子按的比例所组成的立体网状结构;晶体中最小的环是由个Si原子和个O原子组成的元环;1mol SiO2中含molSi—O键。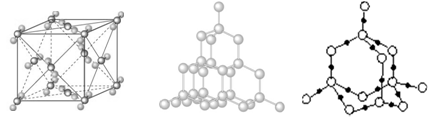
干冰晶胞金刚石晶体结构二氧化硅晶体结构
金刚石晶体中每个碳原子都采取杂化,被相邻的个碳原子包围,以共价键结合形成;晶体中最小的碳环由个碳组成,且同一平面内;晶体中每个C参与了4条C—C键的形成,而在每条键中的贡献只有一半,故C原子与C—C键数之比为;1mol金刚石中含有molC—C键。
干冰晶胞中平均含有个CO2分子;CO2分子的排列方向有种;与一个CO2分子距离最近且相等的CO2分子共有个。
现有三种物质A、B、C,其中有一种是酸,一种是碱,一种是盐,溶于水后电离,可以产生下表中的离子:
| 阳离子 |
Na+ H+Ba2+ |
| 阴离子 |
OH- CO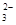 SO SO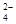 |
为鉴别它们,分别完成以下实验,其结果如下:
① A溶液与B溶液反应生成无色气体X,气体X可以和C溶液反应生成沉淀E,沉淀E可与B溶液反应;
② B溶液与C溶液反应生成白色沉淀D,沉淀D不溶于稀硝酸。
请根据上述实验结果,填空:
(1) 鉴别某溶液中是否含有B中阴离子的实验操作方法是:
(2)完成以下水溶液中的反应的离子方程式:
A溶液与B溶液反应:;
B溶液与沉淀E反应:;
(3) D与E的混合物a g,加入足量盐酸,反应完全生成标准状况时的气体b L,则E在混合物中的质量分数为。
现有下列十种物质:①H2 ②铝 ③CaO ④CO2⑤H2SO4 ⑥Ba(OH)2
⑦红褐色的氢氧化铁液体 ⑧氨水 ⑨稀硝酸 ⑩Al2(SO4)3
(1)上述物质中属于电解质有:(用物质序号填空),
可以利用⑦具有现象这一简单物理方法区分⑦、⑧二种分散系。
(2)上述十种物质中有两种物质之间可发生离子反应:H++OH- H2O,该离子反应对应的化学方程式为。
H2O,该离子反应对应的化学方程式为。
少量的④通入⑥的溶液中反应的离子方程式为。
(3)17.1g⑩溶于水配成250mL溶液,SO42-的粒子数为,
SO42-的物质的量浓度为。
(4)②与⑨发生反应的化学方程式为:Al + 4HNO3 = Al(NO3)3 + NO↑ + 2H2O,
写出该反应的离子方程式并标出电子转移方向和数目:
当有4.48升(标况)NO气体产生时,转移电子的物质的量为,被还原HNO3的质量为克。