实验室配制480 mL 0.5mol/L的NaOH溶液,请填写下列空白:
(1)本实验所必需的仪器有:天平、药匙、烧杯、玻璃棒、________________、_______________。
(2)配制该溶液需取NaOH晶体________________g。
(3)某同学俯视观察液面,会使所配溶液浓度__________(填“偏高”、“偏低”或“无影响”,下同)。
某同学溶解后未冷却至室温便将溶液转移至容量瓶,所配溶液浓度会__________
某同学称量氢氧化钠固体时称量时间过长,所配溶液浓度会__________
(4)若实验过程中出现如下情况应如何处理?加蒸馏水时不慎超过了刻度,应_____________________。
下图甲是课本中验证铜和浓硝酸反应的装置,乙、丙是师生改进后的装置:

(1)写出铜和浓硝酸反应的化学方程式。
(2)和甲装置相比,乙装置的优点。
(3)为了进一步验证NO2和水的反应,某学生设计了丙装置。先关闭弹簧夹,再打开弹簧夹,才能使NO2气体充满②试管。
(4)当气体充满②试管后,欲使烧杯中的水进入②试管应如何操作。
某学生做浓硫酸性质的实验:在一个白色的点滴板的孔穴中分别放入小纸片、少量CuSO4·5H2O。然后如图所示,分别滴入几滴浓硫酸或稀硫酸,观察现象。回答下列问题: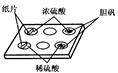
(1)浓硫酸滴入小纸片上,小纸片变 _________(填实验现象),说明浓硫酸具有_________性。
(2)稀硫酸滴入CuSO4·5H2O中,胆矾_________________(填实验现象);浓硫酸滴入CuSO4·5H2O中,胆矾_______________(填实验现象),说明浓硫酸具有_______性。
实验室常用下列装置来进行铜跟浓硫酸反应等一系列实验。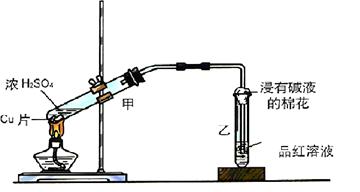
(1)根据什么现象可判断铜跟浓硫酸反应有SO2生成____________;
写出甲装置中发生的主要反应的化学方程式_______________________。
(2)装置乙的试管口部放有一团浸有碱液的棉花,棉花中通常是浸有饱和碳酸钠溶液,其作用是。
(3)实验完毕后,取少量乙试管中溶液于试管中加热,现象是;原因是。
(1)下图所示是实验室中制取气体的一种简易装置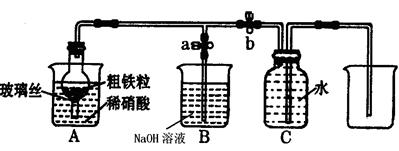
①.甲同学用下列方法检验发生装置的气密性,请问能否达到目的(填能或否)
关闭止水夹a和b,从A处烧杯中加入水,使干燥管与烧杯中液面形成液面差,一段时间后,液面差没有变化,说明气密性良好。
②.实验室利用上图所示发生装置可以制取下列气体。
| A.Cl2 | B.CO2 | C.NH3 | D.SO2 |
(2)乙同学利用该图所示装置,用粗铁粒与3mol·L-1硝酸反应制取NO气体。请回答有关问题。
①NO气体能用排水法收集,而不能用排空气法收集的原因是。
②制取NO时,向A杯中加入稀硝酸,同时打开止水夹a,关闭止水夹b,A装置的干燥管中观察到气体的颜色的变化为。
B装置烧杯中NaOH溶液的作用是。当A装置中气体几乎无色时,打开止水夹b,关闭止水夹a,可用C装置收集NO气体。
③将a mol铁与含b molHNO3的稀溶液充分反应后,若HNO3的还原产物只有NO,反
应后Fe和HNO3均无剩余,则反应中转移电子的物质的量为mol(用含b的代数式示)。
某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表。
| 实验方案 |
实验现象 |
| 1.用砂纸擦后的镁带与热水反应,再向反应后溶液中滴加酚酞 |
A.浮于水面,熔成一个小球,在水面上无定向移动,随之消失,溶液变红色 |
| 2.向Na2S溶液中滴加新制的氯水 |
B.产生气体,可在空气中燃烧,溶液变成浅红色 |
| 3.钠与滴有酚酞试液的冷水反应 |
C.反应不十分强烈,产生的气体可以在空气中燃烧 |
| 4.镁带与2mol.L-1的盐酸反应 |
D.剧烈反应,产生可燃性气体 |
| 5.铝条与2 mol.L-1的盐酸反应 |
E.生成白色胶状沉淀,既而沉淀消失 |
| 6.向AlCl3溶液滴加NaOH溶液至过量 |
F.生成淡黄色沉淀 |
请你帮助该同学整理并完成实验报告
(1)实验目的:;
(2)实验用品:仪器:①②③④⑤镊子⑥小刀⑦玻璃片⑧砂纸 ⑨试管夹
药品:钠、镁带、铝条、2 mol.L-1的盐酸、新制的氯水、Na2S溶液、 AlCl3溶液、NaOH溶液等。
(3)实验内容:(填写与实验方案相对应的实验现象)
123456(用A-F表示);
写出③的离子方程式;
(4)实验结论:;