A、B、C、D、E、F均为前四周期的元素,原子序数依次增大,A的核外电子数等于其电子层数,B的最外层电子数是次外层电子数的3倍,A和C、B和E同主族,B、C、D的离子具有相同的电子层结构,D的离子是同周期中离子半径最小的,F原子中共有6个未成对电子。
请回答下列问题:
⑴写出下列元素的元素符号:A 、C 、E 、F 。
⑵元素A和元素B可以形成A2B物质甲,写出甲的分子式  ,甲为
,甲为  (填“极性”或“非极性”)分子。
(填“极性”或“非极性”)分子。
⑶元素A和元素E形成化合物乙,写出乙的电子式  ;常温下甲为液态,乙为气态,试解释原因 。
;常温下甲为液态,乙为气态,试解释原因 。
⑷元素A与元素C形成化合物丙,丙的水溶液显碱性,试用化学方程式解释其原因:
。
⑸元素C、元素D的最高价氧化物的水化物相互反应的离子方程式是 。
⑹写出元素F的外围电子排布式 。
有机物A~F存在如下转化关系,A的化合物的水溶液呈弱酸性 ,A、C分子中含C、H两元素的质量分数和均为85.19%,相对分子质量均为108。F含两个环且有一个对位甲基。
,A、C分子中含C、H两元素的质量分数和均为85.19%,相对分子质量均为108。F含两个环且有一个对位甲基。
请回答下列问题:
(1)写出化合物A的分子式____________,B的结构简式________________。
(2)与C具有相同环的同分异构体共有____________ _(含C)种,请写出其中两种不同类别有机物的结构简式(除C外)__________________、_____________________。
_(含C)种,请写出其中两种不同类别有机物的结构简式(除C外)__________________、_____________________。
(3)A中处于同一平面上的原子最多有_________个。
(4)写出F的结构简式____________________。
(5)写出反应④的化学方程式_________________________________
A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大。A原子核内无中子;A和E、D和F分别同主族,且B与D最外层电子数之比为2:3。试回答下列问题:
(1)E元素在周期表中的位置是;
(2)已知101KPa时,A单质的燃烧热为285.8kJ/m01,请写出A单质完全燃烧生成液态水时的 热化学方程式:;
热化学方程式:;
(3)E单质在足量D单质中燃烧生成的化合物的电子式是;
(4)化合物X、Y均由A、D、E、F四种元素组成。
①X、Y均属于化合物(填“离子”或“共价”):
②X与Y的水溶液相混合发生反应的离子方程式为;
(5)化合物E2F的水溶液中滴入双氧水和稀硫酸,加热,有单质生成。其离子反应方程式为:。
(8分) (1)A、B、C、D为四种晶体,性质如下:
A.固态时能导电,能溶于盐酸
B.能溶于CS2,不溶于水
C.固态时不导电,液态时能导电,可溶于水
D.固态、液态时均不导电,熔点为3 500℃
试推断它们的晶体类型 :
:
A.________;B.________;C.________;D.________。
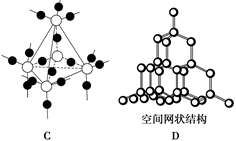
(2)下图中A~D是中学化学教科书上常见的几种晶体结构模型,请填写相应物质的名称:
A.________;B.__________;C.________;D.__________。
A、B、C、D四种元素处于同一周期。在同族元素中,A的气态氢化物沸点最高,B的最高价氧化物对应水化物的酸性在同周期中最强,C的电负性介于A、B之间,D与B相邻。(1)C 原子的价电子排布式为___________________
原子的价电子排布式为___________________
(2)A、B、C三种原子的第一电离能由大到小的顺序是(写元素符号)_____。
(3)B的单质分子中存在①个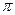 键;D的最简单气态氢化物分子中的中心原子轨道采用②杂化。B和D形成一种超硬、耐磨、耐高温的化合物,该化合物属于③_______晶体,其硬度比金刚石
键;D的最简单气态氢化物分子中的中心原子轨道采用②杂化。B和D形成一种超硬、耐磨、耐高温的化合物,该化合物属于③_______晶体,其硬度比金刚石
④(填“大”或“小”)。
(4)A的气态氢化物的沸点在同族中最高的原因________ ____________________。
____________________。
(6分) 在H2、NH4Cl、SiC、CO2、HF中,由极性键形成的非极性分子有(1)________,由非极性键形成的非极性分子有(2)________,能形成分子晶体的物质是(3)________,含有氢键的晶体的化学式是(4)________,属于离子晶体的是(5)________,属于原子晶体的是(6)________。