一定温度下,在体积为10L的密闭容器中充满NH3,反应2NH3 3H2+N2经5s达到平衡,经测定NH3和H2的浓度均为amol/L,下列叙述中不正确的是
3H2+N2经5s达到平衡,经测定NH3和H2的浓度均为amol/L,下列叙述中不正确的是
| A.反应前后的压强比为5:7 | B.达到平衡时NH3的分解率为40% |
C.N2的平衡浓度为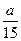 mol/(L·s) mol/(L·s) |
D.NH3在5s内的平均速度为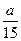 mol/(L·s) mol/(L·s) |
在某100mL混合酸中,HNO3物质的量浓度为0.4mol.L-1,H2SO4物质的量浓度为0.2mol.L-1。向其中加入足量的铜粉,待充分反应后,溶液中Cu2+物质的量浓度为
| A.0.3mol.L-1 | B.0.225mol.L-1 | C.0.15mol.L-1 | D.无法计算 |
下列关于二氧化硫的说法,正确的是
| A.能漂白某些物质,说明其有氧化性 |
| B.能使紫色石蕊试液变红,说明其水溶液呈酸性 |
| C.能用浓硫酸干燥,说明其不具有还原性 |
| D.能使溴水腿色,说明其具有漂白性 |
已知气体的摩尔质量越小,扩散速度越快。下图所示为气体扩散速度的试验,两种气体扩散相遇时形成白色烟环。下列关于物质甲、乙的判断正确的是
| A.甲是浓氨水,乙是浓硫酸 |
| B.甲是浓盐酸,乙是浓氨水 |
| C.甲是浓氨水,乙是浓盐酸 |
| D.甲是浓硝酸,乙是浓氨水 |
下列实验装置图所示的实验操作,不能达到相应实验目的的是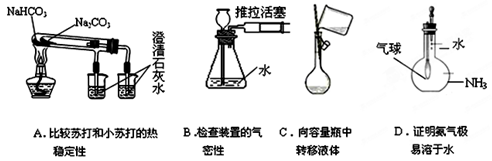
用铁片与稀硫酸反应时,下列措施不能使反应速率加快的是
| A.加热 | B.不用铁片,改用铁粉 |
| C.滴加少量的CuSO4溶液 | D.不用稀硫酸,改用98%浓硫酸 |