(1)在25℃条件下将pH=11的氨水稀释100倍后溶液的pH为(填序号) 。
A.9 B.13 C.11~13之间 D.9~11之间
(2)25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是(填序号)__ ___。
A.氨水与氯化铵发生化学反应 B.氯化铵溶液水解显酸性,增加了c(H+)
C.氯化铵溶于水,电离出大量铵离子,抑制了氨水的电离,使c(OH―)减小
(3)室温下,如果将0.1mol NH4Cl和0.05mol NaOH全部溶于水,形成混合溶液(假设无损失),①__ _和_  __两种粒子的物质的量之和等于0.1mol。
__两种粒子的物质的量之和等于0.1mol。
②_ __和_ __两种粒子的物质的量之和比OH―多0.05mol。
(4)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-) B.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-) D.c(NH4+)>c(Cl- )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
①若溶液中只溶解了一种溶质,该溶质的名称是 ,上述离子浓度大小顺序关系中正确的是(选填序号) 。
②若上述关系中C是正确的,则溶液中溶质的化学式是 。
③若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)(填“>”、“<”、或“=”,下同) c(NH3·H2O),混合后溶液中c(NH4+)与c(Cl-)的关系
c(NH4+) c(Cl-)。
现有三组溶液:①汽油和氯化钠溶液②39%的乙醇溶液⑧氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是
| A.分液、萃取、蒸馏 | B.萃取、蒸馏、分液 |
| C.分液、蒸馏、萃取 | D.蒸馏、萃取、分液 |
选择萃取剂将碘水中的碘萃取出来,这中萃取剂应具备的性质是B
| A.不溶于水,且必须易与碘发生化学反应 | B.不溶于水,且比水更容易使碘溶解 |
| C.不溶于水,且密度必须比水大 | D.不溶于水,且密度必须比水小 |
中国食盐产量居世界首位。下列实验室中的操作类似“海水煮盐”原理的
| A.蒸馏 | B.蒸发 | C.过滤 | D.搅拌 |
下列化学药品与其危险化学品图形标志不一致的一组是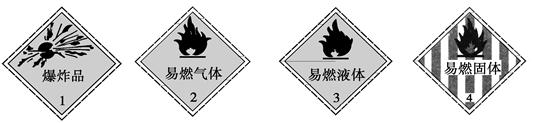
| A.烧碱——1 | B.甲烷——2 | C.酒精——3 | D.白磷——4 |
下列化学实验操作或事故处理方法不正确的是
| A.碱沾到皮肤上时,应立即用大量水冲洗,再涂上硼酸溶液 |
| B.浓硫酸沾到皮肤上时,可立即用湿抹布冲洗,然后涂上3%~5%的NaHCO3溶液 |
| C.酒精灯不慎碰倒起火时,可用湿抹布或沙子盖灭水扑灭,不能用水泼灭 |
| D.配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌条件下慢慢加入浓硫酸 |