(7分)已知在室温的条件下,pH均为5的H2SO4溶液和NH4Cl溶液,回答下列问题:
(1)两溶液中c(H+)·c(OH-)=________。
(2)各取5 mL上述溶液,分别加水稀释至50 mL,pH较大的是________溶液。
(3)各取5 mL上述溶液,分别加热到90℃,pH较小的是________溶液。
(4)两溶液中由水电离出的c(H+)分别为:H2SO4溶液________;NH4Cl溶液________。
(5)取5 mL NH4Cl溶液,加水稀释至50 mL,c(H+)________10-6 mol·L-1(填“>”、“<” 或“=”),c(NH)/c(H+)________(填“增大”、“减小”或“不变”)。
或“=”),c(NH)/c(H+)________(填“增大”、“减小”或“不变”)。
300多年前,著名化学家波义耳发现了铁盐与没食子酸的显色反应,并由此发明了蓝黑墨水。没食子酸的结构式为: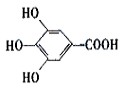
(1)用没食子酸制造墨水主要利用了___类化合物的性质(填代号)。
| A.醇 | B.酚 | C.油脂 | D.羧酸 |
(2)没食子酸丙酯具有抗氧化作用,是目前广泛应用的食品添加剂,其结构简式为_____ ___。
(3)尼泊金酯是对羟基苯甲酸与醇形成的酯类化合物,是国家允许使用的食品添加剂。尼泊金丁酯的分子式为_______,其苯环只与—OH和—COOR两类取代基直接相连的同分异构体有______种。
(4)写出尼泊金乙酯与氢氧化钠溶液加热反应的化学方程式:
_________。
有A、B、C、D四种无色溶液,它们分别是葡萄糖溶液、蔗糖溶液、淀粉溶液、甲酸乙酯中的一种,经实验可知:① B、C均能发生银镜反应② A遇碘水变蓝色③ A、C、D在酸性条件下均能发生水解反应,水解液均能发生银镜反应。试判断
(1)A是__________B是_______________C是________________D是____________
(2)葡萄糖发生银镜反应的化学反应方程式:_______________________________。
(3)甲酸乙酯水解的方程式______________________________________
某温度(t℃)时,水的离子积为Kω=1×10-13,则该温度(选填大于、小于或等于)_______25℃,其理由是_______________________________。若将此温度下pH=11的苛性钠溶液aL与pH=1的稀硫酸bL混合(设混合后溶液体积的微小变化忽略不计),试通过计算填写以下不同情况时两种溶液的体积比:
(1)若所得混合液为中性,则a∶b=_____;此溶液中各种离子的浓度由大到小排列顺序是__________。
(2)若所得混合液的pH=2,则a∶b=____________。此溶液中各种离子的浓度由大到小排列顺序是____________________。
现有四瓶丢失标签的NaOH、Na2CO3、AlCl3、NH4HSO4溶液,为鉴别四瓶溶液,将四瓶溶液编号为A、B、C、D进行实验。实验过程和记录如下图所示(无关物质已经略去):
请回答:
(1)A、W的溶液分别加热蒸干并灼烧最后所得固体为、。
(2)D溶液pH(填“大于”、“小于”或“等于”)7,原因是(用离子方程式表示)。
(3)等物质的量浓度的A、B、C、D溶液pH由大到小的顺序是
。(用化学式表示)
(4)等物质的浓度的C溶液与NH4Cl溶液相比较,c(NH4):前者后者(填“<”“>”“=”)。
(5)若B、C的稀溶液混合后(不加热)溶液呈中性,则该溶液中离子浓度从大到小的顺序是
将含有C、H、O的有机物4.08g,装入元素分析装置,通入足量的O2使它完全燃烧,将生成的气体依次通过盛有氯化钙的干燥管A和盛有碱石灰的干燥管B。测得A管质量增加了2.16g,B管质量增加了10.56g。已知该有机物的相对分子质量为136。
(1)燃烧此化合物4.08g,需消耗氧气的质量是g
(2)求此化合物的分子式
(3)根据有机物的性质确定其可能的结构简式:
①若此有机物为芳香族化合物,其苯环上只有一个取代基,该物质能与氢氧化钠溶液反应,则其结构简式可能为(有几种写几种):
②若此有机物能发生银镜反应、且在常温下能与浓溴水发生取代反应,其苯环上有两个取代基,则其结构简式可能为(写一种)________________________________。