(6分)已知在25℃,AgX、AgY、AgZ均难溶于水,且Ksp(AgX)=1.8×10-10,
Ksp(AgY)=1.0×10-12,Ksp(AgZ)=8.7×10-17。
(1)判断AgX、AgY、AgZ三者的溶解度(用已被溶解的溶质的物质的量/1 L溶液表示)S(AgX)、S(AgY)、S(AgZ)的大小顺序为____________________________。
(2)若向AgY的饱和溶液中加入少量的AgX固体,则c(Y-)________(填“增大”“减小”或“不变”)。
(3)在25℃时,若取0.188 g的AgY(相对分子质量188)固体放入100 mL水中(忽略溶液体积的变化),则溶液中Y-的物质的量浓度为__________________。
(4)由上述Ksp判断,在上述(3)的体系中,________(填“能”或“否”)实现AgY向AgZ的转化,简述理由:________________________________________。
(选考)【选修3:物质结构与性质】
四种常见元素的性质或结构信息如下表。试根据信息回答有关问题。
| 元素 |
A |
B |
C |
D |
| 性质 结构 信息 |
原子核外有两个电子层,最外层有3个未成对的电子 |
原子的M层有1对成对的p电子 |
原子核外电子排布为[Ar]3d104sx,有+1、+2两种常见化合价 |
有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
(1)A元素与其同周期相邻两种元素原子的第一电离能由大到小的顺序为(用元素符号表示);
(2)B元素的低价氧化物分子中心原子的杂化方式为,B元素与D元素形成分子空间构型为;
(3)D元素最高价氧化物的熔点比同主族相邻元素最高价氧化物的熔点(填“高”或“低”),其原因是______________________________________;
(4)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,
观察到的现象为;
(5)C晶体的堆积方式如图所示,设C原子半径为r cm,阿伏伽德罗常数用NA表示,则晶胞中C原子的配位数为_______,C晶体的密度为g·cm-3(要求写表达式,可以不化简)。
Na2S2O3可用作照相的定影剂等。已知Na2S2O3的某些性质如下:
①S2O32-能被I2氧化为无色的S4O62-;
②酸性条件下S2O32-迅速分解为S和SO2
I.市售Na2S2O3中常含有SO42-,请完成以下方案,检验其中含有的SO42-:
| 实验步骤 |
预期现象或结论 |
| 步骤1:取少量固体样品溶于无氧蒸馏水中 |
固体完全溶解得无色澄清溶液 |
| 步骤2:加入过量盐酸 |
|
| 步骤3: |
有白色沉淀产生,说明样品中含有SO42- |
Ⅱ.利用K2Cr2O7标准溶液可以定量测定市售硫代硫酸钠试剂的纯度,步骤为:
①溶液配制:称取1.000gNa2S2O3试样,用新煮沸并冷却的蒸馏水溶解,最终定容至100mL。
②滴定:取10.00mL 0.01000mol·L-1 K2Cr2O7标准溶液,加硫酸酸化,再加过量KI溶液。
③往步骤②所得溶液加入淀粉作指示剂,用Na2S2O3滴定至终点(2S2O32-+ I2="==" S4O62-+ 2I-),记录Na2S2O3溶液用量,平行滴定3次。
(1)步骤①中必须使用的玻璃仪器有烧杯、玻璃棒、和 。
(2)完成并配平步骤②中的离子反应:
Cr2O72- +( ) + I- ===I2+ Cr3++ H2O
(3)若3次滴定Na2S2O3溶液的平均用量为12.00mL,则样品的纯度为(保留两位有效数字)。
工业上利用电解污泥(主要含有Fe2O3、CuO、Cr2O3及部分难溶杂质)回收铜和铬等金属,回收流程如下:
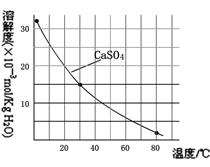
已知部分物质沉淀的pH及CaSO4的溶解度曲线如下:
| Fe3+ |
Cu2+ |
Cr3+ |
|
| 开始沉淀pH |
2.1 |
4.7 |
4.3 |
| 完全沉淀pH |
3.2 |
6.7 |
a |
(1)在浸出过程中除了生成Fe2(SO4)3、Cr2(SO4)3外,主要还有。
(2)在除铁操作中,需要除去Fe3+和CaSO4,请完成相关操作:①加入石灰乳调节pH范围为:~;②将浊液加热到80℃,。
(3)写出还原步骤中加入NaHSO3生成Cu2O固体的离子反应方程式 ,此步骤中加入NaHSO3得到Cu2O的产率为95%,若NaHSO3过量,除了浪费试剂外,还会出现的问题是。
氢是一种重要的非金属元素。氢的单质及其化合物在科学研究和工业生产中有着广泛而重要的作用。
(1)工业上一般采用CO和H2反应合成可再生能源甲醇。反应如下:
CO(g) + 2H2(g)  CH3OH(g) ΔH= -90.1KJ·mol-1
CH3OH(g) ΔH= -90.1KJ·mol-1
在250℃下,将一定量的CO和H2投入10L的密闭容器中,各物质的物质的量浓度(mol·L-1)变化如下表所示:(前6min没有改变条件)
| 2min |
4min |
6min |
8min |
… |
|
| CO |
0.07 |
0.06 |
0.06 |
0.05 |
… |
| H2 |
x |
0.12 |
0.12 |
0.20 |
… |
| CH3OH |
0.03 |
0.04 |
0.04 |
0.05 |
… |
①x=。
②250℃时该反应的平衡常数K的计算式为:(不必化简)。
③若6min~8min只改变了某一条件,所改变的具体条件是。
④第8min时,该反应是不是达到平衡状态。(填“是”或“不是”)
(2)某硝酸厂处理尾气中的NO的方法是用H2将NO还原为N2。已知:
H2还原NO生成氮气和水蒸气的热化学方程式是。
磺酰氯(SO2Cl2)是一种有机氯化剂,也是锂电池正极活性物质。已知磺酰氯是一种无色液体,熔点-54.1℃,沸点69.1℃,遇水发生剧烈水解。
(1)磺酰氯可与白磷发生反应为:P4+ 10SO2Cl2= 4PCl5 + 10SO2↑,若生成1molSO2,则转移电子的物质的量为mol。
(2)某学习小组的同学依据反应:SO2(g)+ Cl2(g) SO2Cl2(g) △H <0,设计的制备磺酰氯装置如图甲。
SO2Cl2(g) △H <0,设计的制备磺酰氯装置如图甲。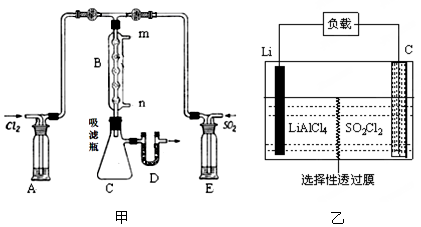
①若用浓盐酸与二氧化锰为原料制取Cl2,其反应的化学方程式为。
②有关题图甲所示的装置说法正确的是(不定项选择)。
a.A、E处洗气瓶中盛放的可能分别是饱和食盐水和饱和Na2SO3溶液
b.D处U形管中盛放的可以是碱石灰
c.B处反应管冷却水应从m接口通入
d.装置C处吸滤瓶若放在冰水中冷却,更有利于SO2Cl2的收集
③从化学平衡移动角度分析,反应管通水冷却的目的为。
(3)GET公司开发的Li-SO2Cl2军用电池,其示意图如图乙所示,已知电池反应为:2Li + SO2Cl2 =" 2LiCl" + SO2↑,则电池工作时,正极的电极反应式为。