(6分)在下列物质
| A.:烧碱, | B.NH3.H2O, |
| C.SO3, | D.铁片,(E)食盐水,(F)甲烷, |
(G)醋酸,(H)碳酸钙中,
属于电解质的是_______ _____,属于非电解质的是________________;
既不属于电解质又不属于非电解质___________ 。
甲醇是一种重要的化工原料。
(1)已知:①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H= -1275.6 kJ·mol—1
②H2O(l)= H2O(g)△H="+" 44.0 kJ·mol—1
写出表示甲醇燃烧热的热化学方程式。
(2)甲醇与水蒸气催化重整可获得清洁能源,具有广泛的应用前景。其反应为:
CH3OH (g)+ H2O (g) CO2(g) +3H2 (g) △H=-72.0kJ/mol
CO2(g) +3H2 (g) △H=-72.0kJ/mol
①该反应的平衡常数表达式为__________________。
②下列措施中能使平衡时n(CH3OH)/n(CO2)减小的是(双选)___________。
| A.加入催化剂 | B.恒容充入He(g),使体系压强增大 |
| C.将H2(g)从体系中分离 | D.恒容再充入1molH2O(g) |
(3)甲醇可以氧化成甲酸,在常温下用0.1000 mol/L NaOH溶液滴定20. 00 mL 0.1000 mol/L 甲酸溶液过程中,当混合液的pH=7时,所消耗的V(NaOH) _________ (填“<”或“>”或“=”) 20. 00 mL。
I.已知在25℃时,HF、HCN和H2CO3的的电离平衡常数如表所示:
(1)写出碳酸的第一级电离平衡常数表达式:K1=。
(2)①往Na2CO3溶液中加入足量HF溶液,发生反应的离子方程式:
②往NaCN溶液中通入少量CO2,发生反应的离子方程式:
II. 用电解法制取金属镁时,需要无水氯化镁。在干燥的HCl气流中加热MgCl2·6H2O时,能得到无水MgCl2,其原因是。
海带中含有丰富的碘。为了从海中提取碘,某研究性学习小组设计并进行了以下实验: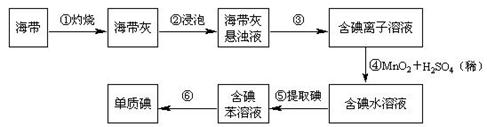
现有下列仪器,请按要求填写以下空白:
(1)其中适用于物质分离的仪器有______________(填名称),使用前需要检验是否漏水的有(填序号)。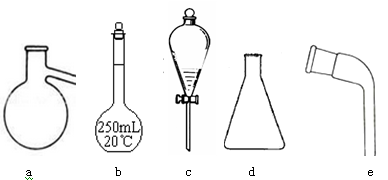
(2)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是(从下列仪器中选出所需的仪器,用标号字母填写在空白处)。
| A.烧杯 | B.坩埚 | C.表面皿 | D.泥三角 E.酒精灯 F.干燥器 |
(3)步骤③除铁架台、烧杯外,还需用到的仪器有;
(4)步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是,上图中还缺少的玻璃仪器是。
(5)步骤⑤中某学生选择用苯来提取碘的理由是。
已知FeCl3溶液能腐蚀铜板,生成CuCl2和FeCl2,请根据要求回答下列问题:
(1)写出该反应的离子方程式并用单线桥法标出电子转移的方向和数目:______________________
(2)向(1)中反应后的溶液中加入酸性KMnO4溶液(锰元素的化合价为+7),还原产物为Mn2+,则参与反应的氧化剂与还原剂的物质的量之比为_____________;判断Cu2+、MnO4-、Fe3+的氧化性由强到弱的顺序是(用离子符号表示)________________________。
某无色透明溶液中可能大量存在OH-、Cl-、Na+、Mg2+、Cu2+中的几种离子。
(1)不做任何实验就可以肯定原溶液中不存在的离子是_______。
(2)取少量原溶液加入铝粉有气体放出,说明原溶液中肯定存在的离子是___________,有关的离子方程式为:____________________________。
(3)另取少量原溶液加入过量稀硝酸,再加几滴AgNO3溶液,出现白色沉淀,说明原溶液中肯定存在的离子有_________。
(4)原溶液中_________(填“肯定存在” 、“肯定不存在”或 “无法确定”) Na+。