实验中需要230mL0.1mol/LNa2CO 3溶液,回答下列问题
3溶液,回答下列问题
(1) 配制溶液时应选用容量瓶的规格_______
(2) 若用托盘天平称量,实际应称碳酸钠的质量_______
(3)用已称好的Na2 CO3固体配制溶液,除容量瓶外还需要的其他仪器
CO3固体配制溶液,除容量瓶外还需要的其他仪器
______ 、 _ 、 _____________
(4)配制时,其正确的操作顺序为 (字母表示,每个字母只用一次)
______ ______________
A.用少量蒸馏水冲洗 2~3 次,将冲洗液移入容量瓶中[
B.将称好的碳酸钠钠固体放入烧杯中,加适量蒸馏水将其溶解
C.将冷却后的碳酸钠溶液转移至容量瓶中
D.最后盖好瓶盖,振荡摇匀
E.改用胶头滴管小心地加水至溶液凹液面与刻度线相切。
F.向容量瓶内加水至刻度线 1~2 cm 处
(5)若实验遇下列情况,溶液的浓度是偏高,偏低还是无影响?
A、加水时越过刻度线 _________
B、定容时俯视刻度线 __________
C、容量瓶内壁附有水珠而未干燥处理 ______
D、固体溶解后没有冷却便进行定容 _____ 
“向海洋进军”,已成为世界许多国家发展的战略口号,海水中通常含有较多的Ca2+、Mg2+、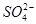 等杂质离子,以海盐为原料的氯碱厂电解饱和食盐水制取NaOH的工艺流程如下:
等杂质离子,以海盐为原料的氯碱厂电解饱和食盐水制取NaOH的工艺流程如下: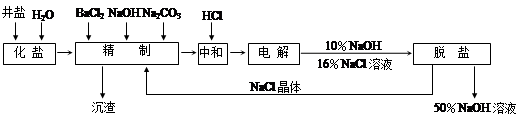
依据上图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极的电极反应式为 ;
(2)电解过程的总反应的化学方程式_________________________________________。
(3)电解槽阳极产物可用于_____________________________(至少写出两种用途)。
(4)工业食盐含Ca2+、Mg2+等杂质,精制过程中除去这2种离子所发生反应的离子方程式为:。
(5)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以是
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(6)为了有效除去Ca2+、Mg2+、SO42-加入试剂的合理顺序为
a.先加NaOH,后加Na2CO3,再加钡试剂
b.先加NaOH,后加钡试剂,再加Na2CO3
c.先加钡试剂,后加NaOH,再加Na2CO3
(7)已知NaOH、NaCl在水中的溶解度数据如下表:
| 温度/℃ |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
90 |
100 |
| NaOH /g |
109 |
118 |
129 |
146 |
177 |
300 |
313 |
318 |
337 |
| NaCl/ g |
36 |
36.3 |
36.6 |
37 |
37.3 |
37.8 |
38.4 |
39 |
39.8 |
根据上述数据,脱盐工序中利用通过 、 (填操作名称)除去NaCl。
氯元素(Cl)是最重要的“成盐元素”,主要以NaCl的形式存在于海水和陆地的盐矿中。食盐不仅是人体必需的物质,而且是重要的化工原料,从海水中提取氯并应用于工农业生产中的图示如下。
(1)粗盐中含有Ca2+、Mg2+、SO42-等杂质、精制后可得饱和NaCl溶液。精制时通常在溶液中依次加入的试剂及操作正确的是 ;
A.过量的BaCl2 过量NaOH
过量NaOH 过量Na2CO3
过量Na2CO3 过滤
过滤 过量HCl
过量HCl
B.过量的NaOH  过量Na2CO3
过量Na2CO3 过量BaCl2
过量BaCl2 过滤
过滤  过量HCl
过量HCl
C.过量的BaCl2 过量Na2CO3
过量Na2CO3 过量NaOH
过量NaOH  过滤
过滤  过量HCl
过量HCl
D.过量的NaOH 过量 BaCl2
过量 BaCl2 过量Na2CO3
过量Na2CO3  过量HCl
过量HCl 过滤
过滤
写出加入盐酸后可能发生的化学反应的离子方程式。
(2)工业上用电解饱和食盐水的方法制取烧碱和氢气、氯气。下图是电解饱和食盐水装置的一部分,请将装置补充完整,并标出阴阳极和通电时溶液中离子移动的方向。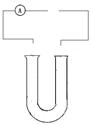
阴极反应式为 ;反应类型(填氧化或还原反应),
总电极反应式为。
(3)在实验室中用浓盐酸与MnO2共热可制取Cl2。
① 下列收集Cl2的装置正确的是;
②检验是否有氯气生成可采用的方法是;
A.用干燥的蓝色石蕊试纸B.用干燥的有色布条
C.用湿润的淀粉碘化钾试纸 D.将气体通入硝酸银溶液
③ 将制得的Cl2与Ca(OH)2充分反应,可制得漂粉精,写出反应的化学方程式。
④ 如下图所示,往漂粉精溶液中持续通入SO2 的过程中,可观察到的现象有(至少写出两点)。
实验室制取乙酸乙酯的主要步骤如下:
①在甲试管(如图)中加入2mL浓硫酸、3mL乙醇和2mL乙酸的混合溶液.
②按如图连接好装置(装置气密性良好)并加入混合液,用小火均匀地加热3~5min。
③待试管乙收集到一定量产物后停止加热,撤出试管并用力振荡,然后静置待分层。
④分离出乙酸乙酯层、洗涤、干燥。
(1)反应中浓硫酸的作用是___________________
(2)甲试管中混合溶液的加入顺序:___________________________________;
(3)上述实验中饱和碳酸钠溶液的作用是(填字母):_______________。
| A.中和乙酸和乙醇。 |
| B.中和乙酸并吸收部分乙醇。 |
| C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出。 |
| D.加速酯的生成,提高其产率。 |
(4)欲将乙试管中的物质分离开以得到乙酸乙酯,必须使用的仪器有__________;分离时,乙酸乙酯应该从仪器________(填:“下口放” 或“上口倒”)出。
(5)生成乙酸乙酯的反应是可逆反应,反应一段时间后,就达到了该反应的限度.下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号)__________
①混合物中各物质的浓度不再变化;②单位时间里,生成1mol乙醇,同时生成1mol乙酸;③单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸.
工业上从海水中提取溴的方法如下:
①将蒸馏(制淡水)后浓缩的海水用硫酸进行酸化;
②向酸化的海水中通入足量氯气,使溴离子转化为溴单质;
③向上述溶液中通入空气和水蒸气,将溴单质吹入盛有二氧化硫水溶液的吸收塔内转化成氢溴酸;
④向吸收塔内通入适量的氯气;
⑤用四氯化碳萃取吸收塔中的溴单质。
请完成下列问题:
(1)在实验室中蒸馏海水制淡水时,常用的仪器除了酒精灯、锥形瓶、牛角管、冷凝管、石棉网及必要的夹持仪器,还需要的玻璃仪器有;蒸馏时碎瓷片的作用是______________________
(2)步骤②中反应的离子方程式为。
(3)步骤③的目的是使溴单质富集,试写出溴单质与二氧化硫水溶液反应的化学方程式。
反应中________(写化学式)是氧化剂。1mol氧化剂在反应中得到_______mol电子。
(4)下列能代替四氯化碳来萃取溴的试剂是 _________(填序号)
| A.盐酸 | B.酒精 | C.乙酸 | D.苯 |
某化学实验小组拟用50mLNaOH溶液吸收CO2气体(用大理石和稀盐酸反应来制取CO2),以制备纯净的Na2CO3溶液。为了防止通入的CO2气体过量生成NaHCO3,他们设计了如下实验过程:
a.取25 mL NaOH溶液,向其中通入过量的CO2气体,至CO2气体不再溶解;
b.小火煮沸此溶液1~2 min;
c.在得到的溶液中加入另一半(25mL)NaOH溶液,使其充分混合反应。
(1)此方案能制得较纯净的Na2CO3,写出a、c两步的化学反应方程式:____________________________________、_____________________________________
(2)煮沸溶液的目的是。
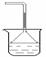
此方案第一步的实验装置如右图所示: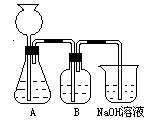
(3)加入反应物前,如何检查整个装置的气密性_________________________________。
(4)装置B中盛放的试剂是____________,作用是__________________________________。
(5)在实验室制法中,装置A还可作为下列_____________气体的发生装置(填序号)。
①CH2=CH2②H2S③CH4④CH≡CH⑤H2
(6)实验室制取下列气体:①NH3,②Cl2,③HCl,④H2S,⑤CH4,⑥CO,⑦CO2,⑧O2时,属于必须进行尾气处理并能用下图所示装置进行处理的,将气体的序号填入装置图的下方空格内。
| 尾 气 吸 收 装 置 |
 |
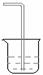 |
| 处理气体 |
(7)已知所用NaOH溶液中溶质的质量分数为40%,室温下该溶液密度为1.44 g / mL,假设反应前后溶液的体积不变,不考虑实验误差,计算用此种方法制备所得Na2CO3溶液的物质的量浓度为_________________。