(1)用水稀释0.1mol/L氨水,溶液中随着水量的增加而减小的是_______(填字母)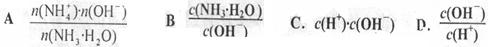
(2)已知25℃时,Ksp(CaSO4)==7.10×10-5.向0.100L含CaSO4固体的溶液中加入2.22gCaCl2粉末充分搅拌,若溶液的体积变化忽略不计,则溶液中CaSO4固体的质量将______ (填“增大”、“减小”或“不变”,下同), Ksp(CaSO 4)将________。
4)将________。
化合物KaFeb(C2O4)c·dH2O(其中铁为正三价)是重要的光化学试剂。通过下述实验确定该晶体的组成。
步骤a:称取该样品4.91g溶于水中配成250mL溶液,取出25mL溶液,向其中加入过量的NaOH溶液,将沉淀过滤,洗涤,高温灼烧至质量不再改变,称量其固体的质量为0.08g。
步骤b:另取出25mL溶液,加入适量稀H2SO4溶液,用0.050 mol·L-1KMnO4溶液滴定,到达滴定终点时,消耗KMnO4溶液24.00mL。
已知:2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2+8H2O
(1)草酸(H2C2O4)为二元弱酸,其一级电离的方程式为 。草酸的Ka1约为Ka2的1000倍,可能的原因是 。
(2)滴定终点观察到的现象为 。
(3)通过计算确定样品的组成(写出计算过程)。
化合物F是一种重要的有机合成中间体,它的合成路线如下: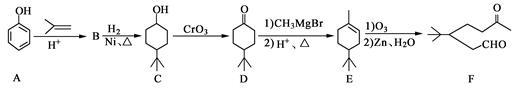
(1)化合物F中含氧官能团的名称是 和 ,由B生成C的化学反应类型是 。
(2)写出化合物C与乙酸反应生成酯的化学方程式: 。
(3)写出化合物B的结构简式: 。
(4)某化合物是D的同分异构体,且分子中只有三种不同化学环境的氢。写出该化合物的结构简式: (任写一种)。
(5)请根据已有知识并结合相关信息,写出以苯酚(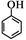 )和CH2=CH2为原料制备有机物
)和CH2=CH2为原料制备有机物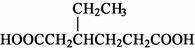 的合成路线流程图(无机试剂任用)。
的合成路线流程图(无机试剂任用)。
合成路线流程图示例如下: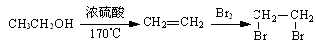
碳及其化合物广泛存在于自然界中,回答下列问题:
(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用 形象化描述;在基态14C原子中,核外存在 对自旋相反的电子。
(2)CS2分子中,共价键的类型有 。
(3)CO能与金属Fe形成Fe(CO)5,该化合物熔点为253K,沸点为376K,其固体属于 晶体。
(4)碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示:
①在石墨烯晶体中,每个C原子连接3个六元环,每个六元环占有 个C原子。
②在金刚石晶体中,C原子所连接的最小环也为六元环,每个C原子连接 个六元环。
现有属于前四周期的A、B、C、D、E、F、G七种元素,原子序数依次增大。A元素的价电子构型为nsnnpn+1;C元素为最活泼的非金属元素,D元素核外有三个电子层,最外层电子数是核外电子总数的1/6;E元素正三价离子的3d轨道为半充满状态,F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;G元素与A元素位于同一主族,其某种氧化物有剧毒。
(1)A元素的第一电离能 B,元素的电负性由小到大的顺序为一电离能(填“<”“>”或“=”),A、B、C三种元素 (用元素符号表示)。
(2)D元素原子的价电子排布式是 。
(3)C元素的电子排布图为 ;E3+的离子符号为 。
(4)F元素位于元素周期表的 区,其基态原子的电子排布式为 。
(5)G元素可能的性质 。
A.其单质可作为半导体材料 B.其电负性大于磷 C.最高价氧化物对应的水化物是强酸
(10分)下表中实线是元素周期表的部分边界,其中上边界并未用实线画出。
根据信息回答下列问题:
(1)基态Ga原子的最外层电子排布式为_________________
(2)铁元素位于元素周期表的__________区;Fe和CO易形成配合物Fe(CO)5,在Fe(CO)5中铁的化合价为__________。
(3)已知:原子数目和价电子总数均相同的微粒互为等电子体,等电子体具有相似的结构特征。与CO互为等电子体的分子和离子分别为__________和__________(填化学式)。
(4)在CH4、CO、CH3OH中,碳原子采取sp3杂化的分子有__________。
(5)根据VSEPR模型预测ED4-的空间构型为__________。B、C、D、E原子相互化合形成的分子中,所有原子都满足最外层8电子稳定结构的分子为__________(写2种)。