研究性学习小组进行了一系列化学实验后,发现高锰酸钾分解后的含锰元素的化合物都能和浓盐酸反应制得氯气,且锰化合物的还原产物都是MnCl2。他们将6.32gKMnO4粉末加热一段时间,也不知道高锰酸钾是否完全分解,收集到0.112L气体后便停止加热了,冷却后放入足量的浓盐酸再加热,又收集到气体体积是(上述气体体积都折合成标准状况)( )
| A.0.448L | B.2.240L |
| C.2.016L | D.无法确定 |
下列说法中,正确的是
| A.强电解质的水溶液一定比弱电解质的水溶液的导电能力强 |
| B.强电解质都是离子化合物,弱电解质都是共价化合物 |
| C.强电解质的水溶液中不存在溶质分子 |
| D.不溶性盐都是弱电解质,可溶性酸和具有极性键的化合物都是强电解质 |
25℃时,将1 mol NH4NO3溶于水,向该溶液滴加b L氨水后溶液呈中性,据此判断下列说法中不正确的是(NH3·H2O的电离平衡常数取Kb=2×10-5mol·L-1)
| A.滴加氨水的过程中,水的电离平衡将正向移动 |
| B.滴加b L氨水后的溶液中,n(NH4+) = 200 n(NH3·H2O) = 1 mol |
| C.所滴加氨水的浓度为0.005 / b mol·L-1 |
| D.滴加b L氨水后的溶液中各离子浓度大小是:c(NH4+) = c(NO3-) > c(H+) = c(OH-) |
下列有关平衡常数(K、Ka、Kw、Ksp)的说法中错误的是
| A.若各平衡常数(K、Ka、Kw、Ksp)的值发生变化,则平衡一定发生移动 |
| B.若温度升高,则各平衡常数一定增大 |
| C.平衡常数的大小能说明反应(或电离、溶解)进行的程度 |
| D.某一可逆反应的平衡常数越大,表明反应(或电离、溶解)进行的程度越大 |
为了说明醋酸是弱电解质,某同学设计了如下实验方案证明,其中错误的是
| A.配制0.10 mol/L CH3COOH溶液,测溶液的pH,若pH大于1,则可证明醋酸为弱电解质 |
| B.用pH计分别测0.01 mol/L和0.10 mol/L的醋酸溶液的pH,若两者的pH相差小于1个单位,则可证明醋酸是弱电解质 |
| C.对盐酸和醋酸溶液进行导电性实验,若与CH3COOH溶液相串联的灯泡较暗,证明醋酸为弱电解质 |
| D.配制0.10 mol/L CH3COONa溶液,测其pH,若常温下pH大于7,则可证明醋酸是弱电解质 |
在一定条件下,Na2CO3溶液中存在水解平衡:CO32-+H2O HCO3-+OH-。下列说法正确的是
HCO3-+OH-。下列说法正确的是
| A.稀释溶液,水解平衡常数增大 | B.通入CO2,平衡向正反应方向移动 |
C.升高温度,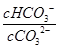 减小 减小 |
D.加入NaOH固体,溶液pH减小 |