硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3 、FeCO3 MgO、CaO等,生产工艺流程示意如下: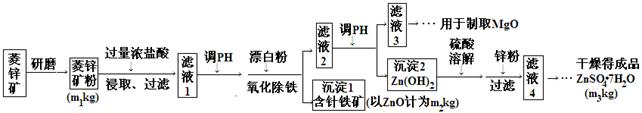
(1)将菱锌矿研磨 成粉的目的是____。
成粉的目的是____。
(2)完成“氧化除铁”步骤中反应的离子方程式:
□Fe(OH)2+□____+□_____==□Fe(OH)3 +□CI-
(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,化学式量为89,化学式是______。
(4)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为______。
| |
Mg(OH)2 |
Zn(OH)2 |
MgCO3 |
CaCO3 |
| 开始沉淀的pH |
10.4 |
6.4 |
— |
— |
| 沉淀完全的pH |
12.4 |
8.0 |
— |
— |
| 开始溶解的pH |
— |
10.5 |
— |
— |
| Ksp |
5.6×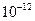 |
— |
6.8× |
2.8×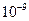 |
(5)工业上从“滤液3”制取MgO过程中,合适的反应物是______(选填序号)。
a.大理石粉 b.石灰乳 c.纯碱溶液 d.烧碱溶液
(6)“滤液4”之 后的操作依次为______、______、过滤,洗涤,干燥。
后的操作依次为______、______、过滤,洗涤,干燥。
(7)分析图中数据,菱锌矿粉中ZnCO3的质量分数不低于________。
(12分) 肼(N2H4)又称联氨,是一种可燃性液体,其燃烧热较大且燃烧产物对环境无污染,故可以用作火箭燃料。
(1)肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。该电池放电时,通入肼的一极为极,该极的电极反应式是。电池工作一段时间后,电解质溶液的pH将(填“增大”、“减小”、“不变”)。
(2)肼用亚硝酸(HNO2)氧化可生成氮的另一种氢化物,该氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977。写出肼与亚硝酸反应的化学方程式
(3)肼和四氧化二氮作火箭推进剂,两者反应产物是氮气和水。当反应生成28.0kg还原产物时,计算参加反应的肼的质量 (写出计算过程) 。
F和G是日常生活中常用的两种合成高分子材料,可由某烃经下列反应得到: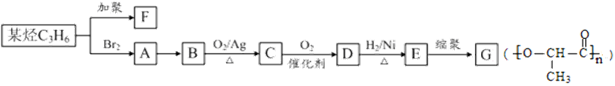
请回答下列问题:
(1)F的名称是,G中所含官能团的名称
(2)A→B的反应条件是D→E的反应类型是
(3)C的结构简式为
(4)H为C的同分异构体,且符合下列条件,其结构简式为
①能使酸性高锰酸钾溶液褪色②能与NaHCO3溶液反应放出气体
(5)E→G的化学方程式是
(12分)硫酸锌是制备荧光粉的原料之一。工业上由锌白矿(主要成分是ZnO,还含有Fe2O3、CuO、SiO2等杂质)制备ZnSO4•7H2O的流程如下:
已知:常温下,溶液中的Fe3+、Zn2+、Fe2+以氢氧化物形式开始沉淀的pH分别为:2.7,5.4,7.6;完全沉淀的pH分别为:3.7,6.5,9.7。
(1)下列能提高浸取过程中浸出效率的措施有
| A.将矿石粉碎 | B.提高浸取温度 | C.适当增加硫酸的浓度 | D.搅拌并适当延长浸取时间 |
ZnO和硫酸反应的离子方程式为
(2)加入适量锌粉后溶液中存在的金属阳离子主要有
(3)氧化过程中H2O2发生反应的化学方程式为
(4)加入适量Ca(OH)2调节溶液pH至~(填范围),促进Fe3+水解完全。Fe3+水解反应的平衡常数表达式K=
(8分)向100mL FeI2溶液中逐渐通入Cl2,会依次生成Cl-、I2、Fe3+、IO3-,其中Fe3+、I2的物质的量随n(Cl2)的变化如图所示,请回答下列问题: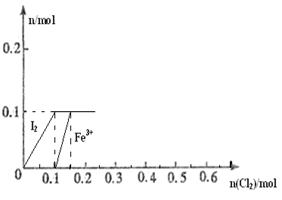
(1)由图可知,I-、Fe2+、I2三种粒子的还原性由强到弱的顺序为___________>____________>____________。
(2)当n(Cl2)=0.12mol时,溶液中的离子主要为__________,从开始通入Cl2到n(Cl2)=0.15mol时的总反应的化学方程式为_____________________________________。
(3)当溶液中n(Cl-):n(IO3-)=8:1时,通入的Cl2在标准状况下的体积为_________
二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。某学生拟用左下图所示装置模拟工业制取并收集ClO2。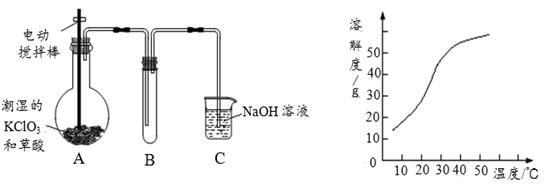
(1)A中反应产物有K2CO3、ClO2和CO2等,请写出该反应的化学方程式:。
(2)A必须添加温度控制装置,除酒精灯外,还需要的玻璃仪器有烧杯、;B也必须添加温度控制装置,应该是(选填“冰水浴”或“热水浴”)装置。
(3)反应后在装置C中可得NaClO2溶液。已知NaClO2饱和溶液中在温度低于38℃时析出晶体是NaClO2·3H2O,在温度高于38℃时析出晶体是NaClO2。根据右上图所示的NaClO2的溶解度曲线,请补充从NaClO2溶液中制得NaClO2的操作步骤:
①;②;③洗涤;④干燥。
(4)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进
行了下列实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100.00 mL试样;量取V1 mL试样加入到锥形瓶中;
步骤2:调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;
步骤3:加入淀粉指示剂,用c mol·L—1 Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。
(已知2 Na2S2O3 + I2= Na2S4O6 + 2NaI)
①滴定过程中,至少须进行两次平行测定的原因是。
②原ClO2溶液的浓度为g / L(用步骤中的字母代数式表示)。