复分解反应是中学化学中常见的一种反应类型。
(1)已知在常温下测得浓度均为0.1 mol·L-1的下列6种溶液的pH值:
| 溶质 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
C6H5ONa |
| pH |
8.8 |
9.7 |
11.6 |
10.3 |
11.1 |
 11.3 11.3 |
复分解存在这样一个规律:一种较强酸与另一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,如:2CH3COOH+Na2CO3 =" 2CH3COONa+CO2↑+H2O " 依照该规律,请判断下列反应不能成立的是___________(填编号)。
A.CO2+H2 O +2NaClO = N
O +2NaClO = N a2CO3+2HClO
a2CO3+2HClO
B.CO2+H2O +NaClO = NaHCO3+HClO
C.CO2 +H2O +C6H5ONa NaHCO3+C6H5OH
NaHCO3+C6H5OH
D.CO2 +H2O +2C6H5ONa Na2CO3+2C6H5OH
Na2CO3+2C6H5OH
E.Na2CO 3+C6H5OH
3+C6H5OH NaHCO3+C6H5ONa
NaHCO3+C6H5ONa
F.CH3COOH+NaCN = CH3COONa+HCN
(2)一些复分解反应的发生还遵循其它的规律。下列转化都属于复分解反应:
①工业上将石灰乳与纯碱溶液混合可制得苛性钠溶液
②侯氏制碱法中,向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打晶体。请根据上述反应,总结出复分解反应发生的另一规律 。
根据这结论,现将Na2S和AgI固体混合搅拌,则反应的离子方程式 。
[化学—选修化学与技术]
通常情况下,当空气中CO2的体积分数超过0.050%时,会引起明显的温室效应。为减小和消除CO2对环境的影响,各国都在限制CO2的排量,同时也加强对CO2创新利用的研究。
(1)目前,推广用超临界CO2(介于气态和液态之问)代替氟利昂作致冷剂,这一做法对环境的积极意义是___________________。
(2)科学家为提取空气中的CO2,把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应使之变为可再生燃料甲醇。流程如下: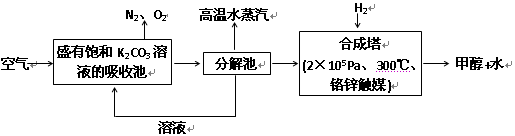
①分解池中反应的化学方程式为:_____________________________。
②合成塔中,若有4.4g CO2与足量H2恰好反应生成气态产物,放出4.947kJ的热量,写出该反应的热化学方程式:________________________。
(3)某同学拟用沉淀法测定空气中CO2的体积分数,他查得CaCO3、BaCO3的溶度积K(sp)分别为4.96×10-9、2.58×10-9。他最好将空气通入足量的__________溶液,实验时除测定温度、压强和空气的体积外,还需要测定_____________。
可逆反应N2+3H2 2NH3是工业上合成氨的重要反应。
2NH3是工业上合成氨的重要反应。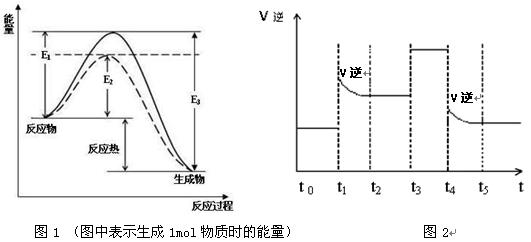
(1)根据图1请写出合成氨的热化学方程式(热量用E1、E2或E3表示)
(2)图1中虚线部分是通过改变化学反应中的条件,请解释原因
。
(3)当反应达到平衡位置时不断改变条件(不改变N2、H2和NH3的量),图2表示反应速率与反应过程的关系,其中表示平衡混合物中NH3的含量最高的一段时间是
(4)在一定温度下,若将4a mol H2和2amol N2放入2L的密闭容器中,充分反应后测得N2的转化率为50%,则该反应的平衡常数为。若此时再向该容器中投入a mol H2、amol N2和2amol NH3,判断平衡移动的方向是(“正向移动”“ 逆向移动”或“不移动”)
(5)将上述实验中产生的NH3通入到0.04mol·L-1的FeCl3溶液中,要使溶液中Fe3+沉淀较完全(即Fe3+浓度降至原来的千分之一),则溶液的pH为(已知常温下,Fe(OH)3的溶度积常数Ksp=4×10-38)
下图涉及的物质所含元素中,除一种元素外,其余均为短周期元素。已知:A、F为无色气体单质,B为具有刺激性气味的气体,C为黑色氧化物,E为红色金属单质(部分反应的产物未列出)。请回答下列问题: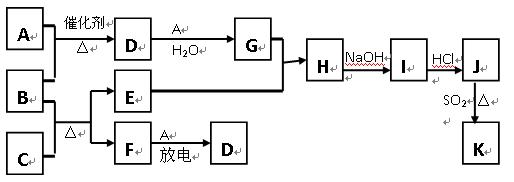
(1)B的电子式为;
(2)写出B和C反应的化学方程式;
(3)写出E与G的稀溶液的离子方程式,并标出电子转移数目:
;
(4)J、K均是同种金属的氯化物,且K为白色沉淀。写出SO2还原J生成K的离子方程式;
(5)汽车尾气中常含有D和CO ,二者在催化剂作用下可以大部分转化为两种对空气无污染的物质,已知:F(g) + A(g) =" 2D" (g) △H = +180.5KJ/mol
2C (s)+ O2 (g)=" 2CO(g)" △H = -221.0 KJ/mol
-221.0 KJ/mol
C (s)+ O2(g) = CO2(g) △H =" -393.5" KJ/mol
则上述尾气转化的热化学方程式为:。
高铁酸钾是一种重要的水的处理剂,实验可用下列流程制取高铁酸钾,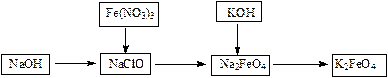
⑴NaClO溶液中加入NaOH固体形成碱性环境。
⑵将研磨的Fe(NO3)3少量多次的加入到上述溶液中,冰浴中反应1h。
采用少量多次加入,其目的是___________________________;该反应的离子方程为:
_____________________________________。
⑶将KOH加入到反应后的溶液搅拌半小时。静置,抽滤的粗产品。该反应的化学方程式为:_____________________________。
⑷依次用甲苯、乙醇、乙醚洗涤以除去水份和KNO3、KCl、KOH等杂质。
⑸在强碱性溶液中,高铁酸钾能将亚铬酸盐(KCrO2)氧化为铬酸盐(K2CrO4),生成的铬酸盐溶液酸化后,得到的重铬酸钾(K2Cr2O7)用Fe(Ⅱ)的标准溶液滴定,以二苯胺磺酸钠为指示剂。到达滴定终点时,溶液由紫色变为淡绿色。现称取5.000 g高铁酸钾样品于烧杯中,加入适量氢氧化钾溶液,加入稍过量的KCrO2,充分反应后,转移到250 mL容量瓶中,定容,量取25.00mL,再用稀硫酸酸化,用0.1000 mol·L-1的(NH4)2Fe(SO4)2标准溶液滴定,用去标准溶液33.33 mL。
①滴定时适宜选用的滴定管是:(a、酸式,b、碱式)。
②计算上述实验制得的样品中,高铁酸钾的质量分数为_________________。
③若上述过程中,测得的样品中高铁酸盐的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有__________。
以硫酸工艺的尾气、氨水、石灰石、焦炭及碳酸氢铵和KCl为原料可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸氢铵等物质且利用率较高。合成路线如下: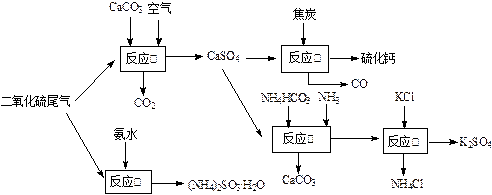
⑴生产中,反应Ⅱ中往往需要向溶液中加入适量的对苯二酚等物质,其目的是 。
⑵下列有关说法正确的是_______________。
| A.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙 |
B.反应Ⅲ中发生反应的化学方程式为:CaSO4+4C CaS +4CO↑ CaS +4CO↑ |
| C.反应Ⅳ需控制在60~70℃,目的之一是减少碳酸氢铵的分解 |
| D.反应Ⅴ中的副产物氯化铵可用作氮肥 |
⑶反应Ⅴ反应液用40%乙二醇溶液,温度控制在25℃,硫酸钾的产率超过90%,其原因是_________________________。
⑷(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为N2,若某尾气含标准状况试写出二氧化氮与亚硫酸铵反应的化学方程式___________________________。