醋酸是日常生活中最常见的调味剂和重要的化工原料,醋酸钠是其常见的盐。
(1)醋酸钠溶液中各离子浓度由大到小的顺序为______________。
(2)对于醋酸溶液和醋酸钠溶液的下列说法正确的是______________(填字母,下同)。
| A.稀释醋酸溶液,醋酸的电离程度增大,而稀释醋酸钠溶液则醋酸钠的水解程度减小 |
| B.升高温度可以促进醋酸电离,而升高温度会抑制醋酸钠水解 |
| C.醋酸和醋酸钠的混合液中,醋酸抑制醋酸钠的水解、醋酸钠也抑制醋酸的电离 |
| D.醋酸和醋酸钠的混合液中,醋酸促进醋酸钠的水解、醋酸钠也促进醋酸的电离 |
(3)物质的量浓度均为 0.1 mol/L 的 CH3COONa 溶液和 CH3COOH 溶液等体积混合(混合前后溶液体积变化忽略不计),混合液中的下列关系式正确的是______________
现有常温条件下甲、乙、丙三种溶液,甲为0.1 mol·L-1的NaOH溶液,乙为0.1 mol·L-1
的HCl溶液,丙为0.1 mol·L-1的CH3COOH溶液,试回答下列问题:
(1)甲溶液的pH=________;
(2)丙溶液中存在的所有电离平衡为_____________________________(用电离方程式表示);
(3)甲、乙、丙三种溶液中由水电离出的c(OH-)的大小关系为________;
有以下物质:①石墨;②铝;③酒精;④氨水;⑤二氧化碳;⑥碳酸氢钠固体;⑦氢氧化钡溶液;⑧纯醋酸;⑨氧化钠固体;⑩氯化氢气体。
(1)其中能导电的是 ;属于非电解质的是 ;属于强电解质的是 ;属于弱电解质的是 。
(2)写出物质⑥溶于水的电离方程式: 。
(3)写出物质⑥和⑧在水中反应的离子方程式: 。
(4)将物质⑥配制成溶液,逐滴加入⑦溶液中至沉淀量最大,写出离子方程式: ,检验离子沉淀完全的方法是 ,洗涤沉淀的方法是 。
在一定条件下,Fe2O3 + 3CO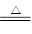 2Fe + 3CO2反应中, (填名称)是氧化剂, (填化学式)发生氧化反应, (填元素符号)元素被氧化,生成42g Fe时转移的电子的物质的量是mol .
2Fe + 3CO2反应中, (填名称)是氧化剂, (填化学式)发生氧化反应, (填元素符号)元素被氧化,生成42g Fe时转移的电子的物质的量是mol .
氯化钠是日常生活的必需品,也是重要的化工原料。
(1)粗盐除含NaCl外,还含有少量MgCl2、CaCl2、Na2SO4以及泥沙等杂质。以下是粗盐提纯的操作流程。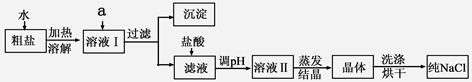
提供的试剂:Na2CO3溶液、K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、饱和NaCl溶液。
①欲除去溶液I中的MgCl2、CaCl2、Na2SO4,从提供的试剂中选出a所代表的试剂,按滴加顺序依次为:过量的NaOH溶液、 、 ;
②在滤液中加盐酸的作用是 ;
(2)用提纯的NaCl配制200g0.9%的生理盐水,需要NaCl的质量为 g。配制该溶液时所需要的玻璃仪器有
配制480 mL 0.5 mol·L-1的NaOH溶液,试回答下列问题:
(1)选择仪器:完成本实验所必需的仪器有:托盘天平、药匙、烧杯、玻璃棒、________、________等。
(2)计算、称量:需称量NaOH固体的质量为________。
(3)溶解、冷却。
(4)转移、洗涤。洗涤烧杯2~3次是为了__________________。
(5)定容、摇匀。定容的具体操作是______________________。
(6)本实验中需要使用玻璃棒,作用是_______、 。
(7)不规范的实验操作会导致实验结果的误差,下列使所配溶液的物质的量浓度偏高的是 ,偏低的是 (填字母序号)
| A.容量瓶洗净后未烘干; |
| B.在溶解过程中有少量液体溅出烧杯外 |
| C.定容时俯视刻度线; |
| D.将称量好的NaOH固体放入小烧杯中溶解,未经冷却立即转移到容量瓶中并定容 |
E.定容后,将容量瓶振荡摇匀后,静置发现液面低于刻度线,于是又加入少量水至刻度线