(本题10分)下面是以化合物I为原料合成一种香精.(化合物VI)的合成路线,反应在一定 条件下进行。化合物Ⅵ广泛用于香精的调香剂。
条件下进行。化合物Ⅵ广泛用于香精的调香剂。
回答下列问题:
(1)化合物I生成化合物Ⅱ的反应原子利用率可达100%,化合物I的结构简式为
。
(2)写出化合物V合成化合物Ⅵ的反应方程式
(3)写出一种可鉴别化合物Ⅲ和Ⅳ的化学试剂:
(4)化合物V的多种同分异构体中,与化合物V官能团种类相同且无支链的共有 种。 (5)化合物Ⅵ不能发生的反应类型是 
| A.加成反应 | B.酯化反应 |
| C.水解反应 | D.加聚反应 |
X、Y、Z三种短周期元素,其单质在常温下都是无色气体,它们的原子序数之和为16。在适当条件下三种单质直接化合,可发生如右图所示变化。已知一个B分子中含有Z元素的原子个数比 C分子中的Z元素的原子个数少一个。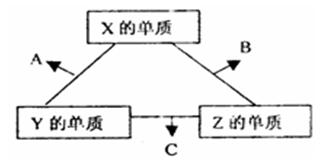
请回答下列问题:
(1)X、Z两元素也可按1:1组合成另一种物质D,D 的电子式为,A与C在一定条件下可生成无污染的物质,请写出该反应的化学方程式
(2)X的单质与Z的单质可制成新型的化学电 源(KOH溶液作
源(KOH溶液作 电解质溶液),两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电。则:正极通入的物质名称是;负极电极反应式为。
电解质溶液),两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电。则:正极通入的物质名称是;负极电极反应式为。
(3)X、Y、Z三种元素可组成一种强酸W,C在适当条件下被W溶液吸收生成一种盐。该盐的水溶液pH7(填“大于”、“小于”或“等于”)其原因是(用离子方程式表示):。
(4)已知Y的单质与Z的单质生成C的反应是可逆反应,△H<0。将等物质的量的Y、Z的单质充入一密闭容器中,在适当催化剂和恒温,恒压条件下反应。下列说法中,正确的是(填写下列各项的序号)。
a.达到化学平衡后,再升高温度,C的体积分数增大
b.达到化学平衡时,Y、Z的两种单质在混合气体中的物质的量之比为1:1
c.反应过程,Y的单质体积分数始终为50%
d.达到化学平衡的过程中,混合气体的密度增大
e.达到化学平衡时,正反应速率与逆反应速率相等
上海世博会英国馆——种子圣殿,由六万多根透明的亚克力[其分子式是(C5H8O2)n]杆构建而成。某同学从提供的原料库中选择一种原料X,设计合成高分子亚克为的路线如图所示: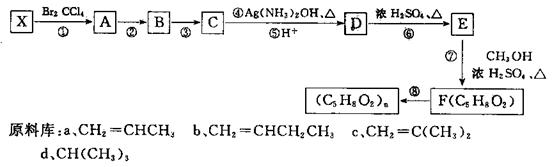
请回答:
(1)原料X是____(选填序号字母),其核磁共振氢谱有____个峰,峰面积之比为。
(2)反应②的条件是____;反应⑧的反应类型是____;
(3)C有多种同分异构体,其中分子中含有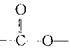 结构的同分异构体有种,请写出其中任意两种的结构简式____、____。D中官能团的名称。
结构的同分异构体有种,请写出其中任意两种的结构简式____、____。D中官能团的名称。
(4)写出⑦的化学方程式。
有E、Q、T、x、z五种前四周期元素,原子序数E<Q<T<X<Z。E、Q、T三种元素的基态原子具有相同的能级,且I1(E)<I1(T)<I1(Q),其中基态E原子占有三个能级且每个能级中电子数目相等,基态Q原子的2p轨道处于半充满状态,X为周期表中前四周期电负性最小的元素,Z的原子序数为28。请回答下列问题(答题时如需表示具体元素,请用相应的元素符号):
(1)氢元素和E、Q两种元素形成分子式为HEQ的化合物,HEQ分子属于分子(填“极性”或“非极性”),分子中有个σ键。
(2)与分子式为ET互为等电子体的离子是(写出一种即可)。基态Z原子的核外电子排布式____。
(3)Q的简单氢化物极易溶于T的简单氢化物,其主要原因有(写两种)。
(4)化合物甲由T、X两种元素组成,其晶胞如图①,甲的化学式为。甲与E的最高价氧化物反应的方程式为。
(5)化合物乙的晶胞如图②,乙由E、Q两种元素组成,硬度超过金刚石。
①乙的晶体类型为;②乙的晶体中Q元素原子的杂化方式为。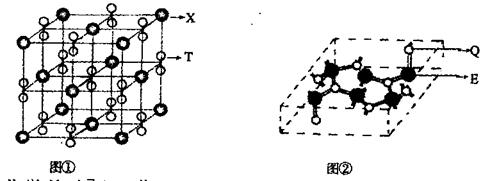
为减少CO2对环境的影响,在限制其排放量的同时,应加强对CO2创新利用的研究。最近科掌家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使空气中的CO2转变为可再生燃料甲醇。“绿色自由”构想技术流程如下: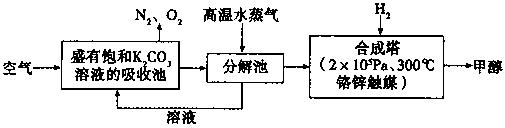
(1)请写出上述流程中分解池中发生反应的化学方程式。
(2)在合成塔中,若有2.2kgCO2与足量H2恰好完全反应,生成气态的水、甲醇,可放出2473.5kJ的热量,试写出合成塔中发生反应的热化学方程式。
(3)若在体积为2L的密闭容器中,充入2molCO2和6rnolH2,一定条件下发生上述反应,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。从反应开始到平衡,v(H2)=;氢气的转化率;能使平衡体系中n(CH3OH)/n(CO2)增大的措施有。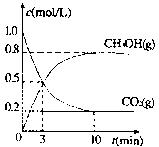
(4)某同学用测定法测定含有较高浓度CO2的空气中CO2的含量,经查得一些物质在20℃的数据如下表。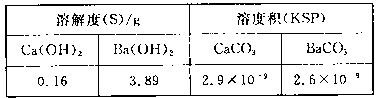
吸收CO2最合适的试剂是____(填“Ca(OH)2”或“Ba(OH)2”)溶液,实验时除需要测定工业废气的体积(折算成标准状况)外,还需要测定____。
(5)“绿色自由”构想技术流程中常包括物质和能量的“循环利用”,上述流程中能体现“循环利用”的除碳酸钾溶液外,还包括。
(6)常温下,0.1 mol/L KHCO。溶液的pH大于8,则溶液中各种离子浓度由大到小的顺序为:____。
下列各物质是中学化学中常见的物质,甲为常见金属单质,乙、丙是非金属单质,其它为化合物,B、D分别为黑色粉末和黑色晶体,G是淡黄色固体,F为棕黄色溶液,①是实验室制取丙的反应之一,各物质间的转化如下图所示,回答下列各问题(部分生成物未列出):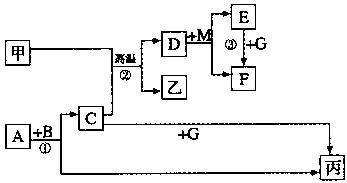
(1)写出A的电子式、B的化学式、甲在周期表中位置是。
(2)写出反应②的化学方程式:。
(3)写出反应③中E与G在中性条件下按物质的量之比2:1反应的离子方程式。
(4)整个转换过程中属于氧化还原反应的有个
(5)物质X常用于对空气进行杀菌、净化和水果保鲜等。X和丙的组成元素相间,X分子中各原子最外层电子数之和为18。X和酸性碘化钾溶液反应生成丙和碘单质,反应的离子方程式是____。