、、、是元素周期表前四周期中的常见元素,其相关信息如下表:
| 元素 |
相关信息 |
| 的基态原子层电子数是层电子数的2倍 |
|
| 的基态原子最外层电子排布式为: | |
| 存在质量数为23,中子数为12的核素 |
|
| 有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
⑴位于元素周期表第
⑵的电负性比的
⑶写出与反应的化学方程式,并标出电子转移的方向和数目:
⑷在原子与氢原子形成的多种分子中,有些分子的核磁共振氢谱显示有两种氢,写出其中一种分子的名称:
(18分)在第3周期中,置换酸中氢的能力最强的元素的元素符号为,化学性质最稳定的元素符号是,最高价氧化物的水化物的酸性最强的化合物的化学式是,碱性最强的化合物的化学式是,显两性的氢氧化物的化学式是,该两性氢氧化物与盐酸、氢氧钠溶液分别反应的离子方程式为、,原子半径最大的金属元素的名称是,离子半径最小的离子结构示意图是。
(16分)下表是元素周期表的一部分,表中所列的字母分别代表某一化学元素。
| h |
|||||||||||||||||
| a |
c |
f |
i |
m |
|||||||||||||
| e |
g |
k |
|||||||||||||||
| d |
(1)表中所列元素中,属于短周期元素的有(写元素符号),
e元素在元素周期表中的位置是周期,族。
(2)下列组元素的单质可能都是电的良导体。
A、a, c, h B 、 i ,g, k C、c, h, m D、 d, e, f
(3)i元素属于(填金属或非金属)元素,它的最高正化合价是
负化合价是。它能跟氧气反应,生成一种吸水性很强的物质,这种物质在实验室里常用做干燥剂,写出它跟氧气反应的化学方程式:。
高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用软锰矿制备高锰酸钾的一种工艺流程。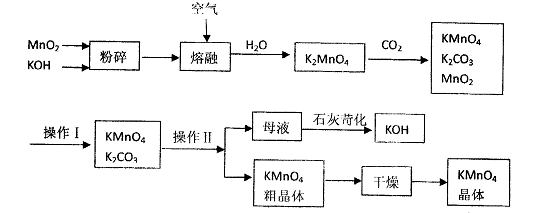
(1)上述流程中可以循环使用的物质有、(写化学式)。
(2)若不考虑制备过程中的损失与物质循环,则1 mol MnO2可制得mol KMnO4;反应中二氧化锰的主要作用是(“氧化剂”、 “还原剂”、“催化剂”)。
(3)操作I的名称是;操作Ⅱ根据KMnO4和K2CO3两物质在(填性质)上的差异,采用 (填操作步骤)、趁热过滤得到KMnO4粗晶体。
(4)写出母液中加入生石灰苛化时的反应总的离了方程式.
(5)该生产中需要纯净的CO2气体。若实验室要制备纯净的CO2,所需试剂最好选择(选填代号)。
| A.石灰石 | B.稀HC1 | C.稀H2SO4 | D.纯碱 |
所需气体发生装置是(选填序号)。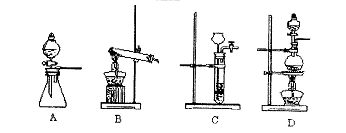
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示。已知W的一种核素的质量数为14,中子数为7;X的离子与N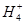 具有相同的质子、电子数目:W与Y的氧化物均能导致酸雨的形成;Z的非会属性在同周期主族元素中最强。
具有相同的质子、电子数目:W与Y的氧化物均能导致酸雨的形成;Z的非会属性在同周期主族元素中最强。
(1)Y在周期表中的位置是。
(2)用电子式表示化合物X3W的结
构 。
(3) X3W遇水可释放出使酚酞溶液变红的气体A,该
反应的化学方程式是。
(4)同温同压下,将a L W的简单氢化物和b LZ的氢化物通入水中,若所得溶液的pH=7则ab(填“>”或“<”或“=”)。
(5)用惰性电极电解化合物XZ溶液从阴极释放出气休B,该反应的离子方程式是。
(6)已知W的单质与气体B在一定条件下可形成气体A,即:
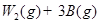
 △H=—92.4kJ·mo1-1
△H=—92.4kJ·mo1-1
在某温度时,一个容积固定的密闭容器中,发生上述反应。在不同时间测定的容器内各物质的浓度如下表:
| 时间 |
浓度(mo1/L) |
||
| c(W2) |
c(B) |
c(A) |
|
| 第0 min |
4.0 |
9.0 |
0 |
| 第10 min |
3.8 |
8.4 |
0.4 |
| 第20 min |
3.4 |
7.2 |
1.2 |
| 第30 min |
3.4 |
7.2 |
1.2 |
| 第40 min |
3.6 |
7.8 |
0.8 |
0min~10min, W2 的平均反应速率。
②反应在第l0min改变了反应条件,改变的条件可能是。
a.更新了催化剂 b.升高温度 c.增大压强 d.增加B的浓度
③若反应从第30min末又发生了一次条件改变,改变的反应条件可能是。
a.更新了催化剂 b.升高温度 c.增大压强 d.减小A的浓度
化合物A在氢氧化钠溶液中加热反应后再酸化可生成B和C。
(1)B是邻位二取代的芳香族化合物,其分子式为C7H6O3。已知B遇FeCl3溶液显紫色,1 mol B与足量Na反应可生成1 mol H2。则B的结构简式为。B与乙醇发生酯化反应生成X的化学方程式为。
(2)C只由C、H、O三种元素组成。其相对分子质量在100~110之间,其中氧的质量分数约为60.4%。则C的分子式为。
(3)已知1 mol C 最多可与1 mol NaHCO3或3 mol Na反应。C在一定条件下可以发生如下图所示的转化(其他产物和水已略去,已知同一个碳原子上连接两个羟基时不稳定,会自动脱水)。
①C中含氧官能团的名称为。
②若C可以由乳酸 经过几步有机反应制得,其中最佳的次序是:。
经过几步有机反应制得,其中最佳的次序是:。
a.消去、加成、水解、酸化 b.氧化、加成、水解、酸化 c.取代、水解、氧化、酸化
③写出由C反应生成D的化学方程式:,反应类型是。
(4)X有多种同分异构体,写出其中满足以下条件的所有同分异构体。
①能发生银镜反应且能水解;②遇FeCl3溶液显紫色;
③苯环上只有两个侧链,且苯环上的一氯代物只有两种。