已知在某温度时发生如下三个反应:
①C + CO2 = 2CO;②C + H2O =" CO" + H2 ③CO + H2O = CO2 + H2
由此可判断,在该温度下,C、CO、H2的还原性的顺序
A.CO﹥C﹥H2 B.CO﹥H2﹥C C.C﹥H2﹥CO D.C﹥CO﹥H2
下列反应属于取代反应的是
| A.甲烷燃烧 | B.乙烯与溴水反应 |
| C.甲烷与氯气在光照下反应 | D.乙烯通入酸性KMnO4溶液中 |
下列物质中,属于烃的是
| A.CH2Cl2 | B.CH3CH2OH |
| C.CH3CHO | D.CH3CH2CH2CH3 CH3 |
下列物质中,不属于化石燃料的是
A.氢气B.煤 C石油 D.天然气
某同学进行了如图所示的实验,由实验现象得到的结论中正确的是
| A.原溶液中一定只含有SO42— |
| B.原溶液中一定含有SO42—和Cl— |
| C.原溶液中一定只含有Cl— |
| D.原溶液中可能含有SO42—,也可能含有Cl— |
将a%的某物质的水溶液加热蒸发掉m g水(溶质不挥发、且蒸发过程无溶质析出),所
得溶液体积为V L,溶质的质量分数为蒸发前的2倍,设溶质的相对分子质量为M,则蒸发后所得溶液的物质的量浓度为
A.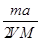 mol/L mol/L |
B. mol/L mol/L |
C.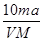 mol/L mol/L |
D. mol/L mol/L |