氧化还原反应的实质是__________________________________ ______;元素的化合价降低,发生的是________________反应;氧化还原反应中,还原剂________________电子(填“得”或“失”);试写出Na2O2与H2O反应的化学方程式,并用双线桥标出电子转移的方向和数目:
______;元素的化合价降低,发生的是________________反应;氧化还原反应中,还原剂________________电子(填“得”或“失”);试写出Na2O2与H2O反应的化学方程式,并用双线桥标出电子转移的方向和数目:
____________________________________________。
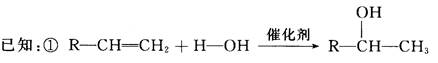
|
②R—CH2—X+H2O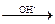 R—CH2OH(R代表烃基,X代表Cl、Br、I原子)现有含C、H或C、H、O的化合物A~F,有关它们的某些信息,已注明在下面的方框内。
R—CH2OH(R代表烃基,X代表Cl、Br、I原子)现有含C、H或C、H、O的化合物A~F,有关它们的某些信息,已注明在下面的方框内。
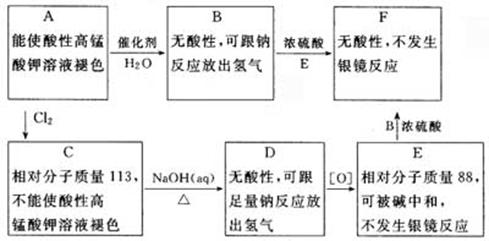

现只有含C、H、O的化合物A~F,有关它们的某些信息如下。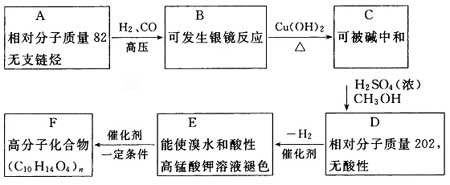
(1)写出A、F的结构简式:A______、F______。
(2)写出B与新制Cu(OH)2浊液反应的化学方程式:____________。
A+2B+H2O C+D
C+D
当加水稀释时,平衡向_______(填“正”或“逆”)反应方向移动,理由是
。

(1)按图所示的虚线方向观察,能否看出两次平衡容器内颜色深浅的变化?并请说明理由。
答:
(2)按图8—1所示的实线方向观察(活塞无色透明),能否看出两次平衡容器内颜色深浅的变化?并请说明理由。
答: