X、Y、Z、R、M是元素周期表中原子序数依次增大的五种短周期元素,其相关信息如下表:
| 元素 |
相关信息 |
| X |
X的一种核素的原子核中没有中子 |
| Y |
Y原子的核外电子占据4个原子轨道 |
| Z |
Z的气态氢化物能使湿润的红色石蕊试纸变蓝 |
| R |
R是地壳中含量最高的元素 |
| M |
M的单质与冷水剧烈反应,生成的强碱中含有电子数相同的阴阳离子 |
(1)Y、Z、R的第一电离能从大到小的顺序是________________(填元素符号)
(2)Z、R的最简单氢化物中稳定性强的是________,沸点高的是________(填化学式)
(3)甲是由上述3种元素组成的常见化合物,常温下pH=3的甲溶液中由水电离c(H+)=10-3mol/L,则甲的化学式是________。
(4)直线型分子Y2Z2中所有原子都达到8电子稳定结构,则分子中σ键与π键的个数之比是________。(5)常温下0.58gY4H10完全燃烧放出29kJ的热量,请写出Y4H10燃烧热的热化学方程式____________。
(10分)下图是合成一种高分子的部分流程,反应均在一定条件下进行,某些含N杂环的化合物性质类似于苯环。试填空:
(1)乙与苯酚的关系是:(选填字母序号)。
A.互为同系物 B.互为同分异构体 C.同属芳香族化合物 D.均属芳香烃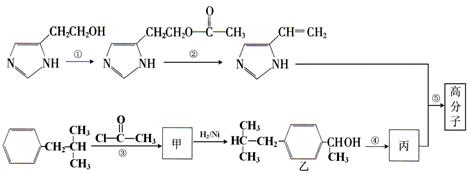
(2)写出反应类型①。
(3)写出消去反应②的化学方程式(不必注明反应条件):
。
(4)写出加聚反应⑤的化学方程式(两反应物的物质的量为1:1,不必注明反应条件)
。
(5)下列说法正确的是(选填字母序号)。
A.甲物质属于酯类化合物
B.丙物质既能使酸性高锰酸钾溶液褪色,又能使溴的CCl4溶液褪色。
C.乙分子的1H-NMR(核磁共振氢谱)的特种峰的面积比为6:3:2:2:2:1:1:1
D.化合物乙与金属钠反应不生成氢气
(10分)芳樟醇是贵重的香料,它可由多种方法合成。
(1)芳樟醇的一种工业合成路线如下: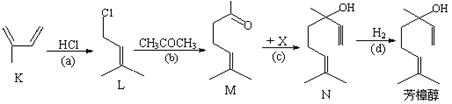
①上图中K的名称是:;
②已知c是加成反应,反应c中另一反应物X的结构式为:。
③L的同分异构体很多,其中只含一个甲基的链状同分异构体有种(不考虑立体异构)。
(2)芳樟醇的另一种常见合成路线如下:β-菠烯在600-700℃时可以开环生成月桂烯,月桂烯与HCl加成后再与CH3COONa反应转化为芳樟醇的乙酸酯,最后经水解得到芳樟醇。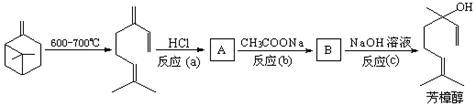
①A的结构简式为:;
②写出B生成芳樟醇的化学反应方程式;
过渡金属催化的新型碳-碳偶联反应是近年来有机合成的研究热点之一,如反应①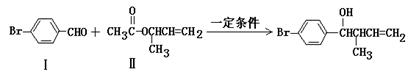
化合物Ⅱ可由化合物Ⅲ合成: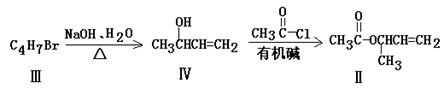
(1)化合物I的分子式为______________。
(2)化合物Ⅱ与Br2加成的产物的结构简式为____________。
(3)化合物Ⅲ的结构简式为______________。
(4)在浓硫酸存在和加热条件下,化合物Ⅳ易发生消去反应生成不含甲基的产物,该反应方程式为______________(注明反应条件)。因此,在碱性条件下,由Ⅳ与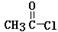 反应合成Ⅱ,其反应类型为___________。
反应合成Ⅱ,其反应类型为___________。
(5)Ⅳ的一种同分异构体V能发生银镜反应。V与Ⅱ也可发生类似反应①的反应,生成化合物Ⅵ,Ⅵ的结构简式为___________(写出其中一种)。
(5分) 在某些酶的催化下,人体内葡萄糖的代谢有如下过程: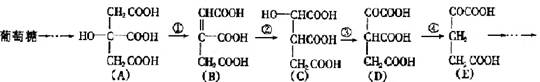
请填空:
(1)过程①是反应,过程②是反应,过程③是反应(填写反应类型的名称)。
(2)过程④的另一种生成物是(填写化学式)。
(3)上述物质中和互为同分异构体(填写字母代号)。
(3分)近来研究认为松果体分泌物——“退黑素”(英文名称melatonin,简称MLT)与人的寿命长短有关、有人把“退黑素”和克隆技术并称为“二十世纪生命科学的两大发现”。退黑素的化学结构简式为: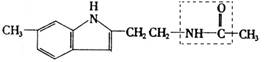
(1)退黑素的分子式为
(2)退黑素结构简式中,虚线框内的结构名称为,它在稀硫酸中受热后生成的具有酸性的物质的最简式为。