(5分) 在某些酶的催化下,人体内葡萄糖的代谢有如下过程: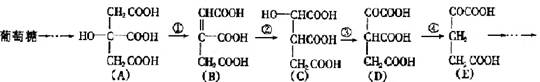
请填空:
(1)过程①是 反应,过程②是 反应,过程③是 反应(填写反应类型的名称)。
(2)过程④的另一种生成物是 (填写化学式)。
(3)上述物质中 和 互为同分异构体(填写字母代号)。
下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题:
族 周期 周期 |
IA |
0 |
||||||
| 1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
| 2 |
② |
③ |
④ |
|||||
| 3 |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
 (1)9种元素中,原子半径最小的是。
(1)9种元素中,原子半径最小的是。
(2)④、⑤、⑥三种元素形成的简单离子中,离子半径最大的是。
(3)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是__________________。
(4)元素③的氢化物的电子式为;该氢化物常温下和⑨的氢化物两者反应的实验现象是,上述反应得到一种盐,属于化合物(填离子或共价)。检验该盐溶液中阳离子存在的方法是
(5)⑤和⑧两元素可形成化合物,该化合物灼烧时火焰颜色为色,用电子式表示该化合物的形成过程。
(6)写出⑥的最高价氧化物与⑤的最高价氧化物对应水化物反应的离子方程式。 (7)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为____________(填序号)。
(7)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为____________(填序号)。 A.MnO2 B.FeCl3 C.Na2SO3 D.KMnO4
A.MnO2 B.FeCl3 C.Na2SO3 D.KMnO4
工业上用乙烯和氯气为原料合成聚氯乙烯(PVC)。已知次氯酸能跟乙烯发生加成反应:CH2=CH2+HOCl→CH2(OH)CH2Cl。以乙烯为原料制取PVC等产品的转化关系如下图所示。
试回答下列问题:
(1)B中官能团是 G的结构简式是 。
(2)⑤、⑦的反应类型分别是: 、 。
(3)写出D的两种同分异构体的结构简式: 。
(4)写出反应⑥的化学方程式:______________________________________。
(5)写出C与D按物质的量之比为1∶2反应生成H的化学方程式:______ _。
在下列物质中选择相应的序号填空:
①甲烷②乙烯③甲苯④1-丁醇⑤乙酸乙酯⑥甘氨酸
Ⅰ.分子结构为正四面体的是;Ⅱ.能发生水解反应的是;
Ⅲ.能与溴水反应并使其褪色的是;Ⅳ.与酸或碱都能反应生成盐的是;
Ⅴ.能发生消去反应的是;
A~G是几种烃的分子球棍模型,据此回答下列问题: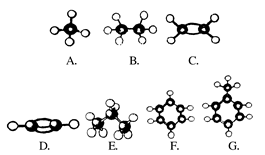
(1)常温下含碳量最高的气态烃是(填对应字母)________;
(2)能够发生加成反应的烃有(填数字)____种;
(3)一卤代物种类最多的是(填对应的字母)____;
(4)写出C发生加聚反应的化学方程式________________;
(5)写出G合成烈性炸药(TNT)的化学方程式____________。
如下图是常见仪器的部分结构。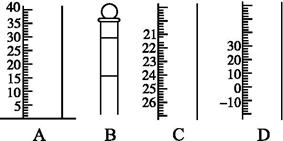
(1)写出仪器名称A ,B ,C ,D。
(2)使用前需检查是否漏水的仪器有 。