(10分)下图是合成一种高分子的部分流程,反应均在一定条件下进行,某些含N杂环的化合物性质类似于苯环。试填空:
(1)乙与苯酚的关系是: (选填字母序号)。
A.互为同系物 B.互为同分异构体 C.同属芳香族化合物 D.均属芳香烃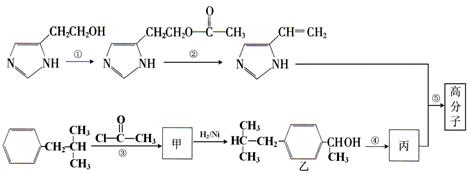
(2)写出反应类型① 。
(3)写出消去反应②的化学方程式(不必注明反应条件):
。
(4)写出加聚反应⑤的化学方程式(两反应物的物质的量为1:1,不必注明反应条件)
。
(5)下列说法正确的是 (选填字母序号)。
A.甲物质属于酯类化合物
B.丙物质既能使酸性高锰酸钾溶液褪色,又能使溴的CCl4溶液褪色。
C.乙分子的1H-NMR(核磁共振氢谱)的特种峰的面积比为6:3:2:2:2:1:1:1
D.化合物乙与金属钠反应不生成氢气
乙醇是一种重要的有机化工原料,它可以用玉米、薯类等为原料经发酵、蒸馏制成。乙醇和汽油经加工处理形成的车用燃料即乙醇汽油。结合有关知识,回答下列问题:
(1)在试管里加入2mL乙醇。把一端弯成螺旋状的铜丝放在酒精外焰中加热,使铜丝表面生成一薄层黑色的氧化铜,立即把它插入盛有乙醇的试管里(如图),取出铜丝,可以观察到铜丝表面。
(2)写出乙醇与氧气催化氧化的化学反应方程式。
(3)乙醇汽油作为一种新型车用燃料,符合我国的能源战略,推广使用乙醇汽油的好处是(写出一条即可)。
(3分)已知维生素A1的键线式如下,线的交点与端点处代表碳原子,并用氢原子补足四价,但C、H原子未标记出来。
请回答下列问题:
(1)维生素A1是一类重要的维生素,写出其含氧官能团的名称。
(2)维生素A1的结构简式如上图,若1mol维生素A1分子最多可跟__ molH2发生加成反应
(8分)(1)A、B两元素均位于周期表中第三周期,它们的原子核外最外层电子数之和为7,其中A元素的原子核外最外层电子数为1个,两者间可形成化合物A2B。根据以上条件回答:
①写出A、B的元素符号:A,B
②写出化合物A2B的电子式。
(2) 现有A、B、C、D四种物质,它们之间能发生如下图所示的转化关系
溶液B、C中都含有金属元素E,溶液B的颜色为黄色。请根据以上信息回答下列问题:
①写出金属E元素符号:
②写出金属A和溶液B反应的离子方程式:
③为了检验溶液B中金属阳离子,通常加入的试剂是
(4分)(1) 写出乙醇与乙酸反应生成酯的化学方程式。
(2) 写浓盐酸与二氧化锰加热反应来制取氯气的化学方程式_________。
如右图,一定温度下,分别往容积均为 5L 的甲(恒压容器)、乙(恒容容器)中加入 0.5mol无色的N2O4气体,立即出现红棕色。当反应进行到 2s时,测得乙容器中N2O4的浓度为 0.09mol·L-1。经过 60s,乙容器中的反应达到平衡。(反应过程中两个容器的温度均保持恒定)
(1)容器中气体出现红棕色的原因(用化学方程式表示)是:。(2)前 2s内乙容器中以N2O4的浓度变化表示的反应速率为。
(3)达到平衡时,甲容器中反应所需的时间60s(填“大于”、“小于”或“等于”,以下同);容器内N2O4的浓度甲乙;反应过程中吸收的能量甲乙。