铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图:
已知:①4FeO·Cr2O3+ 8Na2CO3+ 7O2 8Na2CrO4 + 2 Fe2O3 + 8CO2↑;
8Na2CrO4 + 2 Fe2O3 + 8CO2↑;
②Na2CO3 + Al2O3 2NaAlO2 + CO2↑;③ Cr2O72-+ H2O
2NaAlO2 + CO2↑;③ Cr2O72-+ H2O 2CrO42- + 2H+
2CrO42- + 2H+
根据题意回答下列问题:
(1)固体X中主要含有_________(填写化学式);要检测酸化操作中溶液的pH是否等于4.5,应该使用__________(填写仪器或试剂名称)。
(2)酸化步骤用醋酸调节溶液pH<5,其目的是_________________________________。
(3)操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、 、过滤、_______、干燥。
(4)下表是相关物质的溶解度数据,操作Ⅲ发生反应的化学方程式是:Na2Cr2O7+2KCl →K2Cr2O7↓+2NaCl。该反应在溶液中能发生的理由是_______________。
| 物质 |
溶解度/(g/100g水) |
||
| 0°C |
40°C |
80°C |
|
| KCl |
28 |
40.1 |
51.3 |
| NaCl |
35.7 |
36.4 |
38 |
| K2Cr2O7 |
4.7 |
26.3 |
73 |
| Na2Cr2O7 |
163 |
215 |
376 |
(5)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量是称取n g样品,加入过量______(填写试剂)、溶解、过滤、再______(填写试剂)、……灼烧、冷却、称量,得干燥固体m g 。计算样品中氢氧化铝的质量分数为_______(用含m、n的代数式表示)。
(6)六价铬有毒,而Cr3+相对安全。工业含铬(CrO3)废渣无害化处理的方法之一是干法解毒,用煤不完全燃烧生成的CO还原CrO3。在实验室中模拟这一过程的装置如下:
CO由甲酸脱水制得;实验结束时熄灭酒精灯的顺序是_________________________。
兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示: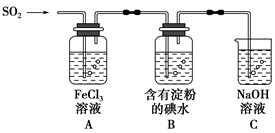
(1)SO2气体还原Fe3+的产物是________(填离子符号),参加反应的SO2和Fe3+的物质的量之比是________。
(2)下列实验方案适用于在实验室制取所需SO2的是________。
A.Na2SO3溶液与HNO3B.Na2SO3固体与浓硫酸
C.固体硫在纯氧中燃烧D.铜与热浓H2SO4
(3)装置C的作用是________________________________________________。
(4)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、过滤、自然干燥,在这一系列操作中没有用到的仪器有________(填序号)。
A.蒸发皿 B.石棉网 C.漏斗 D .烧杯
E.玻璃棒F.坩埚
(5)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入酸性KMnO4溶液,紫红色褪去。
方案②:往第二份试液中加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
方案③:往第三份试液中加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是________,原因是________________________________
(6)能表明I-还原性弱于SO2的现象是________________________________
某种粗盐中含有泥沙、Ca2+、Mg2+、Fe3+、SO等杂质。某同学在实验室中设计了用这种粗盐制备精盐的方案如下(用于沉淀的试剂稍过量):
请回答以下问题:
(1)为操作Ⅳ选择所需仪器(用标号字母填写):________。
A.烧杯 B.试管 C.玻璃棒 D.分液漏斗 E.漏斗 F.酒精灯
G.蒸发皿
(2)操作Ⅲ中常用Na2CO3溶液、NaOH溶液、BaCl2溶液作为除杂试剂,则加入除杂试剂的顺序为:NaOH溶液→________→________。
(3)操作Ⅲ中,判断加入BaCl2已过量的方法是___________________________________
(4)操作Ⅴ应选择的酸是________,若将操作Ⅴ与操作Ⅳ的先后顺序对调,将会对实验结果产生的影响是___________________________________
(5)操作Ⅵ是________(选择合理操作的名称,用标号字母按操作先后顺序填写)。
a.过滤、洗涤B.蒸发、浓缩 c.萃取、分液 D.冷却、结晶
(创新预测题)塑化剂是工业上被广泛使用的高分子材料助剂,在塑料加工中添加这种物质,可以使其柔韧性增强,容易加工。塑化剂可合法用于工业生产,但禁止作为食品添加剂。截止2011年6月8日,台湾被检测出含塑化剂食品已达961种,据媒体报道,2012年岁末,我国大陆多种著名品牌白酒也陷入了塑化剂风波。
常见塑化剂为邻苯二甲酸酯类物质,某有机物J(C19H20O4)是一种塑料工业中常用的塑化剂,可用下列合成路线合成。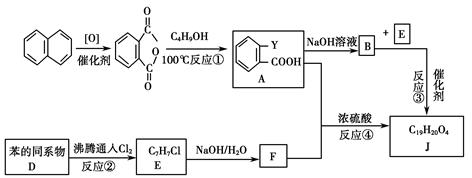
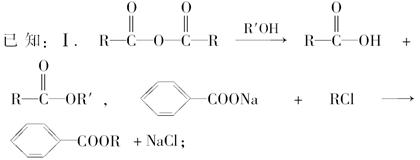
Ⅱ.控制反应条件,使物质A中的支链Y不与NaOH溶液发生反应;
Ⅲ.F与浓溴水混合不产生白色沉淀。
请回答下列问题:
(1)E中官能团的名称为________;F中官能团的电子式为________。
(2)写出A+F―→J的化学反应方程式________________________________。
(3)写出下列化学反应类型:反应①___________________;
反应④________________。
(4)写出F的属于芳香烃衍生物的同分异构体的结构简式:____________。
(5)C4H9OH的同分异构体中属于醇类的有________种,写出其中具有手性碳的同分异构体的结构简式:________________。
(6)以含碳原子数不同的苯的同系物为原料,可以合成不同种类的塑化剂。教材中苯及其同系物的通式是CnH2n-6(n≥6),某同学根据等差数列公式推导出该系列的通式却是Cn+5H2n+4,老师告诉该同学他推导出的通式也是正确的,但其中n的意义和取值范围与教材中的通式不同,请问:通式Cn+5H2n+4中n的意义是________,其取值范围是________。
芳香化合物A是一种基本化工原料,可以从煤和石油中得到。OPA是一种重要的有机化工中间体。A、B、C、D、E、F和OPA的转化关系如下所示:
回答下列问题:
(1)A的化学名称是________。
(2)由A生成B的反应类型是________。在该反应的副产物中,与B互为同分异构体的化合物的结构简式为________。
(3)写出C所有可能的结构简式________。
(4)D(邻苯二甲酸二乙酯)是一种增塑剂。请用A,不超过两个碳的有机物及合适的无机试剂为原料,经两步反应合成D。用化学方程式表示合成路线________________________________________________________________。
(5)OPA的化学名称是________;OPA经中间体E可合成一种聚酯类高分子化合物F,由E合成F的反应类型为________,该反应的化学方程式为_______________________________________________________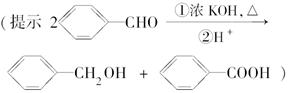
(6)芳香化合物G是E的同分异构体,G分子中含有醛基、酯基和醚基三种含氧官能团,写出G所有可能的结构简式________。
某课题组以苯为主要原料,采用以下路线合成利胆药——柳胺酚
已知:
回答下列问题:
(1)对于柳胺酚,下列说法正确的是________。
| A.1 mol柳胺酚最多可以和2 mol NaOH反应 |
| B.不发生硝化反应 |
| C.可发生水解反应 |
| D.可与溴发生取代反应 |
(2)写出A→B反应所需的试剂________。
(3)写出B→C的化学方程式________________________________。
(4)写出化合物F的结构简式__________。
(5)写出同时符合下列条件的F的同分异构体的结构简式________________
________________________________________(写出3种)。
①属酚类化合物,且苯环上有三种不同化学环境的氢原子。
②能发生银镜反应。
(6)以苯和乙烯为原料可合成聚苯乙烯,请设计合成路线(无机试剂及溶剂任选)
注:合成路线的书写格式参照如下示例流程图: