水是自然界中普遍存在的一种物质,根据下列信息回答问题: (1)
(1) 氧原子基态时价层电子的电子排布图为_______ _________。
氧原子基态时价层电子的电子排布图为_______ _________。
(2)已知2H2O = H3O+ + OH—,H3O+的立体构型是___________________,中心原子的杂化类型是__________________。
(3)s轨道与s轨道重叠形成的共价键可用符号表示为:δs-s,p轨道与p轨道以“头碰头”方式重叠形成的共价键可用符号δp-p,则H2O分子含有的共价键用符号表示为_________。
(4)试比较同主族元素的氢化物H2O、H2S和H2Se的稳定性和沸点高低,并说明理由。
稳定性:  理由:
理由:  。
。
沸点: 理由: 。
已知A、B为气体单质,其中A为黄绿色气体,B为无色气体; C为化合物,其水溶液呈酸性;D为银白色金属单质,E为浅绿色溶液。它们之间有下列转化关系: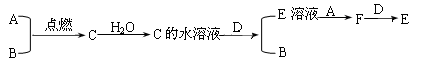
(1)试写出A、B、D、E的化学式:
A_________;B_________;D____________;E________。
(2)写出A与B反应的化学方程式:;
(3)若往E溶液中加入NaOH溶液,并露置于空气中一段时间,可观察到的现象是;
(4)E+A反应的离子方程式:;
F+D反应的离子方程式:。
(12分) 现有下列十种物质:
①H2②铝③CaO④CO2⑤H2SO4⑥Ba(OH)2
⑦红褐色的氢氧化铁液体⑧氨水⑨稀硝酸⑩Al2(SO4)3
(1)上述各物质按物质的分类方法填写表格的空白处(填物质编号):
| 分类标准 |
金属单质 |
氧化物 |
溶液 |
胶体 |
电解质 |
| 属于该类的物质 |
(2)上述十种物质中有两种物质之间可发生离子反应:H++OH-= H2O,该离子反应对应的化学方程式为__________________________________________________________。
(3)⑩在水中的电离方程式为__________________________________________________,
(4)少量的④通入⑥的溶液中反应的离子方程式为________________________________。
(5)②与⑨发生反应的化学方程式为:Al + 4HNO3 = Al(NO3)3 + NO↑ + 2H2O,该反应的氧化剂是____________(填化学式),氧化剂与还原剂的物质的量之比是_____________,当有5.4g Al发生反应时,转移电子的物质的量为_________________。该反应的离子方程式为______________________________。
(3分)粗盐提纯实验中,除去泥沙的三个基本操作是:、、。
在下图所示的物质转化关系中(反应条件已略去)。A是海水中含量最多的盐,B是最常见的无色液体,D、E、F、H为单质。反应①是海水资源综合利用的重要反应,反应②常用于钢轨的焊接,工业上用C与D反应制备漂白液。
请回答下列问题:
(1)E的化学式为__________。
(2)C的电子式为__________。
(3)F元素在元素周期表中的位置是__________。
(4)反应③的离子方程式为__________。
(5)反应④的化学方程式为__________。
(6)若G具有磁性,则反应②中每生成1mol H转移电子的数目为__________。
(10分)有A、B、C、D四种离子化合物,组成它们的离子分别为:
阳离子:Na+、Al3+、NH4+;阴离子:OH-、NO3-、CO32-、HSO4-
为鉴别四种化合物,某学生分别取少量固体配成溶液,编号为A、B、C、D进行实验。实验过程和记录如下图所示(无关物质已略去)

(1) Y、Z的化学式分别为:Y;Z
(2)写出指定反应的离子方程式:
①加热条件下,C与过量B反应:
②D溶液显弱碱性的原因是(用离子方程式表示)
(3)等物质的量浓度的A、B、C、D溶液pH由大到小的顺序是(用化学式表示)
(4)若B、C的稀溶液混合后(不加热)溶液呈中性,则溶液中离子浓度从大到小的顺序是: