已知A、B为气体单质,其中A为黄绿色气体,B为无色气体; C为化合物,其水溶液呈酸性;D为银白色金属单质,E为浅绿色溶液。它们之间有下列转化关系: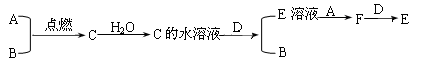
(1)试写出A、B、D、E的化学式:
A_________;B_________;D____________;E________。
(2)写出A与B反应的化学方程式: ;
(3)若往E溶液中加入NaOH溶液,并露置于空气中一段时间,可观察到的现象是 ;
(4)E+A反应的离子方程式: ;
F+D反应的离子方程式: 。
下列物质:①H2O ②石墨 ③NH4NO3④液态氯化氢⑤冰醋酸 ⑥蔗糖
属于强电解质的是;属于弱电解质的是;属于非电解质的是(用编号填写)。
写出下列反应的离子方程式:
(1)钠与水反应_________ ______________________________
______________________________
(2)碳酸钙与盐酸混合_________________________________________________
(3)硫酸铜溶液和氢氧化钡溶液混合______________________________________
(4)电解饱和食 盐水制取氯气____________________________________________
盐水制取氯气____________________________________________
向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续加氨水,难溶物溶解,得到深蓝色的透明溶液;若加入 极性较小的溶剂(如乙醇),将析出深蓝色的晶体。
极性较小的溶剂(如乙醇),将析出深蓝色的晶体。
(Ⅰ)在化学实验和科学研究中,水是一种最常用的溶剂。水是生命之源,它与我们的生活密切相关。
(1) 写出与
写出与 分子互为等电子体的微粒(填1种)。
分子互为等电子体的微粒(填1种)。
(2)水分子在特定条件下容易得到一个 ,形成水合氢离子(
,形成水合氢离子( )。下列对上述过程的描述不
)。下列对上述过程的描述不 合理的是。
合理的是。
| A.氧原子的杂化类型发生了改变 | B.微粒的形状发生了改变 |
| C.微粒的化学性质发生了改变 | D.微粒中的键角发生了改变 |
(3) 分子内的O-H键、分子间的范德华力和氢键从强到弱依次为_____________
分子内的O-H键、分子间的范德华力和氢键从强到弱依次为_____________
(Ⅱ)胆矾晶体是配制波尔多液的主要原料,波尔多液是一种保护性杀菌剂,广泛应用于树木、果树和花卉上。
(4)写出铜原子价电子层的电子排布式,与铜同一周期的副族元素的基态原子中最外层电子数与铜原子相同的元素有(填元素符号)。
(5) 向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续加氨水,难溶物溶解,得到深蓝色的透明溶液;以上过程中发生的离子反应方程式为:
_______________________________;_______________________________。实验时形成的深蓝色溶液中的阳离子内存在的全部化学键类型有。
(6)实验过程中加入 后可观察到析出深蓝色
后可观察到析出深蓝色 晶体。实验中所加
晶体。实验中所加 的作用是__________________________________________________
的作用是__________________________________________________
右图是元素周期表的另一种画法——三角形元素周期表的一部分,图上标有第ⅦA族和碳、钾两种元素的位置。回答下列问题:
⑴请在右图中将过渡元素所在的位置“用斜线”画出。
⑵R的第一电离能A的第一电离能(填大于、小于或等于);写出铷元素原子的外围电子排布式;
⑶R的氢化物在A的氢化物中溶解度极大,原因是;
A的氢化物比B的氢化物热稳定性强,原因是。
⑷图中A、B两元素形成的离子 中,B元素呈现最高价,B原子位于由A原子组成的四面体的中心,且所有原子的最外层电子均满足8电子结构。该离子可能具有的化学性质是_________,依据是_______________________________。
中,B元素呈现最高价,B原子位于由A原子组成的四面体的中心,且所有原子的最外层电子均满足8电子结构。该离子可能具有的化学性质是_________,依据是_______________________________。
⑸第三周期8种元素按单质熔点(℃)高低的顺序如右图,(已知序号“1”代表Ar),其中序号 “8”代表(填元素符号);其中电负性最大的是(填下图中的序号)。
⑹C、Si为同一主族的元素,CO2和SiO2化学式相似,但结构和性质有很大不同。CO2中C与O原子间形成σ键和π键,SiO2中Si与O原子间不形成上述π键。从原子半径大小的角度分析,为何C、O原子间能形成,而Si、O原子间不能形成上述π键的原因
_______________________________________________________________
短周期中五种元素A、B、C、D、E原子序数依次增大,其中A、B、C原子核外电子层数之和是5,且C原子最外层上的电子数为A和B两元素原子最外电子层上电子数的总和,C原子的价电子构型为 ,A原子的最外层电子数等于其电子层数。D和E可以形成原子个数比为1:1和1:2的两种离子化合物,且D原子的2p能级上有两个未成对电子,试回答下列问题:
,A原子的最外层电子数等于其电子层数。D和E可以形成原子个数比为1:1和1:2的两种离子化合物,且D原子的2p能级上有两个未成对电子,试回答下列问题:
(1)B、C、D、E四种元素的原子,半径从大到小的顺序是(填元素符号或化 学式,下同);第一电离能从大到小的顺序是
学式,下同);第一电离能从大到小的顺序是
(2)C原子的电子排布图 _____________,D2-的结构示意图___________。A、D可形成多种化合物,其中一种是氧化剂,其水溶液有弱酸性,写出该化合物的结构式________________,分子中含有_____________________键(填“极性”或“非极性”,下同)是__________分子。
_____________,D2-的结构示意图___________。A、D可形成多种化合物,其中一种是氧化剂,其水溶液有弱酸性,写出该化合物的结构式________________,分子中含有_____________________键(填“极性”或“非极性”,下同)是__________分子。
(3) A、B、D三种元素可以形成多种有机化合物分子,其中最简单原子数最少的一种是室内装潢时形成的主要气体污染物。试写出它的电子式__,根据价层电子对互斥(VSEPR)理论推测该分子中心原子的杂化方式为杂化,空间构型为__。
(4) C和E形成一种离子化合物Y,其摩尔质量为65 g/mol,Y受热或撞击时立即分解为两种单质。则Y的化学式为,Y的阴离子是一种弱酸根离子,全由C元素组成,Y与盐酸反应的离子方程式为。