在一定条件下,对于密闭容器中进行的反应:P(g) + Q(g)  R(g) + S(g)。下列说法中可以充分说明这一反应已经达到化学平衡的是
R(g) + S(g)。下列说法中可以充分说明这一反应已经达到化学平衡的是
| A.P、Q、R、S的浓度相等 |
| B.P、Q、R、S在密闭容器共存 |
| C.P、Q、R、S的浓度不再变化 |
| D.用P来表示的反应速率与用Q表示的反应速率相等 |
张青莲是我国著名的化学家,1991年他准确测得In的相对原子质量为114.818,被国际相对原子质量委员会采用为新的标准值。这是相对原子质量表中首次采用我国测定的相对原子质量值。则下列有关的说法中,错误的是
A.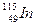 原子核外有49个电子 原子核外有49个电子 |
B.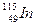 原子核内有49个中子 原子核内有49个中子 |
C.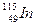 原子核内质子数和中子数之和等于其质量数,为115 原子核内质子数和中子数之和等于其质量数,为115 |
D.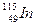 是In元素的一种核素 是In元素的一种核素 |
已知某饱和溶液的(1)体积、(2)密度、(3)溶质和溶剂的质量比、(4)溶质的摩尔质量,要根据溶质的溶解度计算某饱和溶液的物质的量浓度时,在上述条件中必不可少的是
| A.(1)(3) | B.(3) | C.(2)(4) | D.(2)(3) |
下列溶液中,跟100 mL 0.5 mol·L-1NaCl溶液中的Cl-物质的量浓度相同的是
| A.100 mL 0.5 mol·L-1 MgCl2溶液 |
| B.200 mL 0.25 mol·L-1 CaCl2溶液 |
| C.50 mL 1.0 mol·L-1 NaCl溶液 |
| D.25 mL 0.5 mol·L-1 HCl溶液 |
向一定量的下列物质的溶液中逐滴加入氢氧化钠溶液,先生成白色沉淀,后沉淀逐渐溶解。这种物质是
| A.MgSO4 | B.NaAlO2 | C.AlCl3 | D.FeCl3 |
A、B、C、D、E分别是 Cu、Ag、Fe、Al、Mg五种金属中的一种。已知:(1)A、C均能与稀 H2SO4反应放出气体;(2)B与D的硝酸盐反应,置换出单质D;(3)C与强碱反应放出气体;(4)C、E在冷的浓H2SO4中发生钝化反应,由此可以推断A、 B、 C、 D、E依次为
A.Fe、Cu、Al、Ag、Mg
B.Al、Cu、Mg、Ag、Fe
C.Mg、Cu、Al、Ag、Fe
D.Mg、Ag、Al、Cu、Fe