在一固定容积的密闭容器中,保持一定条件下进行以下反应:X(气)+2Y(气)  3Z(气)。已知加入1 molX和3molY。达到平衡后,生成a mol Z。
3Z(气)。已知加入1 molX和3molY。达到平衡后,生成a mol Z。
(1)在相同实验条件下,若在同一容器中改为加入2 mol X和6 mol Y,达到平衡后,Z的物质的量为 。
X和6 mol Y,达到平衡后,Z的物质的量为 。
(2)在相同实验条件下,若在同一容器中改为加入0.5molX,则需加入 mol Y,加入 mol Z,才能使平衡时Z为0.9 a mol。
下图是一个化学过程的示意图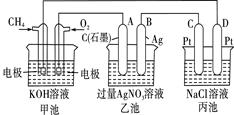
回答下列问题:(1)甲池是装置,电极A的名称是。
(2)甲装置中通入CH4的电极反应为
乙装置中B(Ag)的电极反应式为,
丙装置中D极的产物是(写化学式),
(3)一段时间,当丙池中产生112mL(标准状况下)气体时,均匀搅拌丙池,所得溶液在25℃时的pH =_______。(已知:NaCl溶液足量,电解后溶液体积为500 mL)。
若要使丙池恢复电解前的状态,应向丙池中通入(写化学式)。
电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的印刷电路板铜箔.某工程师为了从使用过的腐蚀废液中回收铜,并重新获得FeCl3溶液,准备采用下列流程: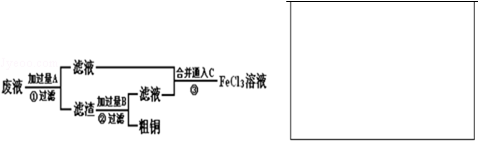
(1)写出流程①中回收金属铜时发生反应的离子方程式.
请根据上述反应设计一个原电池,在方框中画出简易装置图(标出相应电极名称、电极材料、电解质溶液).
(2)写出图流程③相关反应的化学方程式:.
(3)如下图为相互串联的甲、乙两个电解池(电极都是惰性电) 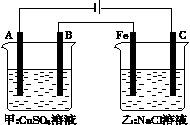
请回答:
①写出两电解池中的电解反应方程式:
甲_________________
乙
②若甲槽阴极增重12.8 g,则乙槽阳极放出气体在标准状况下的体积为________。
③若乙槽剩余液体为400 mL,则电解后得到碱液的物质的量浓度为______。
(1)25℃时,浓度为0.1 mol·L-1的6种溶液:
①HCl, ②CH3OOH, ③Ba(OH)2,④Na 2CO3,⑤KCl,⑥NH4Cl溶液
pH由小到大的顺序为__________________(填写编号)。
(2)25℃时,醋酸的电离常数Ka=1.7×10-5mol/L,则该温度下CH3COONa的水解平衡常数
Kh=mol ·L-1(保留到小数点后一位)。
(3)25℃时,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后,溶液呈(填“酸性”,“中性”或“碱性”),请写出离子浓度大小关系式:。
(4)25℃时,将m mol/L的醋酸和n mol/L的氢氧化钠溶液等体积混合后,溶液的pH=7,则溶液中c(CH3COO-)+ c(CH3COOH)=,m与n的大小关系是mn(填“>”“=”或“<”)。
(8分)(1)现有0.1 mol·L-1的纯碱溶液,试用pH试纸测定溶液的pH,其正确的操作是
___________;____________
纯碱溶液呈碱性的原因是(用离子方程式表示)__________________________
(2)为探究纯碱溶液呈碱性是由CO32-引起的,请你设计一个简单的实验方案:
__________________________。_______________________。
(3)为证明盐的水解是吸热反应,四位学生分别设计了如下方案,其中正确的是______。
| A.甲学生:在醋酸钠溶液中滴入2滴酚酞溶液,加热后红色加深,说明盐类水解是吸热反应 |
| B.乙学生:在盐酸中加入氨水,混合液温度上升,说明盐类水解是吸热反应 |
| C.丙学生:将硝酸铵晶体溶于水,水温下降,说明盐类水解是吸热反应 |
| D.丁学生:在氨水中加入氯化铵固体,溶液的pH变小,说明盐类水解是吸热反应 |
(3分)下列有关实验的说法正确的是。
| A.在测定中和反应的反应热实验中,至少要读两次温度 |
| B.可用pH试纸测定新制氯水的pH |
| C.中和滴定实验中,洗净后的锥形瓶不需要干燥 |
| D.向CH3COONa溶液中滴入石蕊试液,溶液变蓝 |
E.向白色ZnS沉淀上滴加CuSO4溶液,沉淀变为黑色,说明Ksp(ZnS)〈Ksp(CuS)