含硫化合物的种类很多,现有SO2、Na2SO3、H2SO4、CuSO4这4种常见的含硫化合物。回答下列问题:
(1)为进一步减少SO2的污染并变废为宝,我国正在探索在一定条件下用CO还原SO2的方法来除去SO2。写出该反应的化学方程式:_________________。
(2)亚硫酸钠和碘酸钾在酸性溶液中发生以下反应:
Na2SO3+ KIO3+ H2SO4== Na2SO4+ K2SO4+ I2+ H2O。
①配平上面的氧化还原反应方程式。
②若反应中有5 mol电子转移,则生成的碘单质是______mol。
(3)向FeCl3和BaCl2的酸性混合溶液中通入SO2气体,有白色沉淀生成。此沉淀是______。
| A.BaSO4 | B.FeS | C.BaSO3 | D.S |
(4)常温下,将铁棒置于浓硫酸中,课本上解释为发生了钝化,但有人认为未发生反应。为验证此过程,某同学经过思考,设计了如下实验:将经浓硫酸处理过的铁棒洗净后置于CuSO4溶液中,若铁棒表面________,则发生了钝化。
氮化铝(AlN)是一种新型无机材料,广泛应用于集成电路生产领域。若某氮化铝中含有碳或氧化铝中的一种,现用图I中的一些装置来进行检验,使氮化铝样品和NaOH溶液反应:AlN+NaOH+H2O=NaAlO2+NH3↑,根据反应中所生成氨气的体积来测定样品中的氮化铝的质量分数,并根据实验现象来确定杂质的成分(实验中导管体积忽略不计)。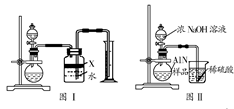
(1)实验有关操作为:a.往烧瓶中放入适量的AlN样品:b.从分液漏斗往烧瓶中加入过量的浓NaOH溶液:c.检验装置的气密性;d.测定收集到水的体积。
正确的操作顺序为:。
(2)本实验中(图Ⅰ)检查装置气密性的方法是:。
(3)广口瓶中的试剂X可选用(填选项前的标号)。
| A.汽油 | B.酒精 | C.植物油 | D.CCl4 |
(4)实验结束后,若观察到烧瓶中还有固体,则样品中含有的杂质是。
(5)若实验中测得样品的质量为w g,氨气的体积为a L(标况下),则样品中AlN的质量分数为:。
(6)有人改用图Ⅱ装置进行同样实验,通过测定烧杯中硫酸增加的质量来确定样品中AlN的质量分数。你认为是否可行?(填“可行”或“不可行”),原因是。
某研究小组测量菠菜中草酸及草酸盐的含量(以C2O42-计)。实验步骤如下:
①将菠菜样品预处理后,热水浸泡,过滤得到含有草酸及草酸盐的溶液。
②调节溶液的酸碱性,滴加足量CaCl2溶液,产生白色沉淀;加入足量醋酸,使CaCO3溶解;过滤得到CaC2O4固体。
③用稀HCl溶解CaC2O4并加水配制100 mL溶液。每次准确移取25.00 mL该溶液,用0.0100 mol·L-1 KMnO4标准溶液滴定,平均消耗标准溶液V mL。
回答下列问题:
(1)步骤①中“样品预处理”的方法是(A.灼烧成灰,B.研磨成汁)。
(2)步骤②中“调节溶液的酸碱性”至(A.弱碱性,B.弱酸性,C.中性)。验证CaCl2溶液已“足量”的操作和现象是。
(3)步骤③中用到的玻璃仪器除烧杯、锥形瓶、胶头滴管、玻璃棒外,还有。
硫酸亚铁晶体(FeSO4·7H2O)在医药上可作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下:
请回答下列问题:
(1)步骤②加入过量H2O2的目的是。
(2)步骤③中反应的离子方程式为。
(3)步骤④中的一系列操作依次为:过滤、、灼烧、、称量。
(4)若实验无损耗,则每片补血剂含铁元素的质量为g(用含a的代数式表示,不用化简)。
(5)该小组有些同学认为用KMnO4溶液滴定也能进行铁元素含量的测定。反应原理为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需要的玻璃仪器为;
②上述实验中的KMnO4溶液需要酸化,可用于酸化的酸是。
a.稀硝酸 b.稀硫酸 c.稀盐酸 d.浓硝酸
化学是一门以实验为基础的自然科学,进行化学实验时要熟悉中学化学实验中常见仪器及用品,采取正确的实验操作,注意实验安全。
(1)在仪器:a.分液漏斗、b.试剂瓶、c.集气瓶、d.滴定管、e.容量瓶、f.量筒、g.托盘天平中,标有“0”刻度的是(填序号,下同);标有具体使用温度的是。
(2)“磨砂”是增加玻璃仪器密封性的一种处理工艺。在下列仪器中,没有用到“磨砂”工艺处理的有。
a.试管
b.分液漏斗
c.带滴管的试剂瓶(滴瓶)
d.集气瓶
e.酸式滴定管
f.碱式滴定管
(3)下列操作所得实验结果比实际数值偏高的是( )
a.用量筒量取8.5 mL液体时,俯视液面读数
b.中和滴定达到终点时,仰视液面读数
c.配制一定物质的量浓度的溶液定容时,仰视溶液液面
(4)在盛放浓硫酸的试剂瓶的标签上印有如图所示的警示标志,说明浓硫酸是一种。
(5)有同学想用下图所示装置以大理石和稀盐酸反应制取CO2,老师指出,这需要太多的稀盐酸,造成浪费,该同学选用了实验室最常用的一种仪器,加在装置上,解决了这个问题。请你把该仪器画在图中合适的位置。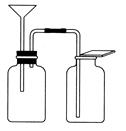
乙基香草醛( )是食品添加剂的增香原料,其香味比香草醛更加浓郁。
)是食品添加剂的增香原料,其香味比香草醛更加浓郁。
(1)乙基香草醛分子中的含氧官能团有乙氧基、(写名称)、(写名称)。核磁共振谱表明该分子中有种不同类型的氢原子。
(2)乙基香草醛的同分异构体A是一种有机酸,A可发生以下变化: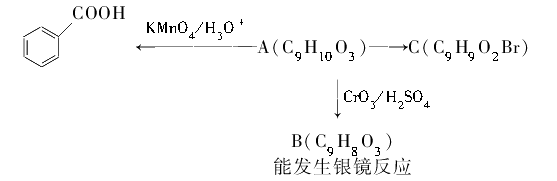 提示:
提示: b.与苯环直接相连的碳原子上有氢时,该碳原子才可被酸性KMnO4溶液氧化为羧基
b.与苯环直接相连的碳原子上有氢时,该碳原子才可被酸性KMnO4溶液氧化为羧基
①写出A的结构简式:。
②写出在加热条件下C与NaOH水溶液发生反应的化学方程式:。