物质结构与性质下表为元素周期表的一部分。请回答下列问题:
(1)上述元素中,属于s区的是 (填元素符号)。
(2)写出元素⑨的基态原子的价电子排布图 。
(3)元素的第一电离能:③ ④(选填“大于”或“小于”)。
(4)元素③气态氢化物的VSEPR模型为 ;该分子为 分子(选填“极性”或“非极性”)。向硫酸铜溶液中逐滴加入其水溶液,可观察到的现象为 。
(5)元素⑥的单质的晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示。
若已知⑥的原子半径为dcm,NA代表阿伏加德罗常数,元素⑥的相对原子质量为M,请回答:晶胞中⑥原子的配位数为 ,该晶体的密度为 (用字母表示)。
写出分子组成为C5H11Br的有机物的同分异构体中,只能发生水解反应,不能发生消去反应的物质的结构简式,并命名。
在后面的横线上,填出反应的类型。
(1)CH3Br+OH-CH3OH+Br-____________________
(2) ________________________
________________________
(3) ________________________
________________________
现通过以下步骤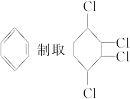 由制取,过程如下所示:
由制取,过程如下所示:

(1)从左到右依次填写每步反应所属的反应类型:
①__________,②__________,③__________,④__________,⑤__________,⑥__________。
(2)写出①③④⑤步反应的方程式。
①____________________________________________________________。
③____________________________________________________________。
④____________________________________________________________。
⑤____________________________________________________________。
已知:1,3-丁二烯(CH2==CH—CH==CH2)与足量的氯气发生加成反应可以生成1,2,3,4-四氯乙烷(CH2Cl—CHCl—CHCl—CH2Cl)。现以氯苯为原料经以下步骤制取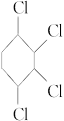 。
。

(1)①③步反应属于_________反应类型,B的结构简式为_________。
(2)②步反应所需的试剂和条件是__________________。
(3)写出④⑤两步的化学方程式: __________________、________________。
一卤代烃RX与金属钠作用,可以增加碳链制取高级烃。反应的化学方程式为
RX+2Na+R′XR R′+2NaX其中X表示卤原子,R和R′表示为烃基,可以相同,也可以不同。试以苯、乙炔、Br2、HBr、Na为主要原料通过三步反应制取
R′+2NaX其中X表示卤原子,R和R′表示为烃基,可以相同,也可以不同。试以苯、乙炔、Br2、HBr、Na为主要原料通过三步反应制取 。其制取的化学方程式为:
。其制取的化学方程式为:
①__________________________________________________;
②__________________________________________________;
③__________________________________________________。