下图是有关气体制取和性质探究的部分实验装置。
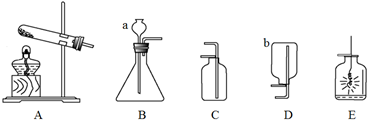
请你回答下列问题:
(1)写出图中标有字母的仪器名称:a ;b 。
(2)B装置中仪器a必须伸入液面以下的原因是 。
(3)实验室采用氯酸钾为原料制取氧气时,应选用的发生装置是 (填字母)。如图E所示,铁丝在氧气中剧烈燃烧说明氧气具有 (填“氧化性”或“可燃性”)。
(4)实验室用大理石和稀盐酸制取二氧化碳,应选用的收集装置是___ ___(填字母);此反应的化学方程式为 。
G是一种用于合成抗血栓药的中间体,其合成路线如下:
已知:HCHO+CH3CHO CH2=CHCHO+H2O。
CH2=CHCHO+H2O。
(1)E中含氧官能团的名称为_________,C转化为E的反应类型为。
(2)B与适量H2加成可得对甲基苯甲醇,对甲基苯甲醇的同分异构体中,遇FeCl3溶液显紫色的有种。B与新制氢氧化铜反应的化学方程式为;
(3)一元醇F中氧的质量分数为50%,写出E生成酯G的化学方程式。
(4)G在一定条件下可以生成高聚物H,H的结构简式为_________________________。
某烃A 0.2mol在氧气中完全燃烧后生成化合物B、C各1.2mol,试回答:
(1)烃A的分子式为。
(2)若烃A不能使溴水褪色, 但在一定条件下,能与氯气发生取代反应,其一氯代物只有一种, 则此烃A的结构简式为。
(3)若烃A能使溴水褪色, 在催化剂作用下与H2加成, 其加成产物经测定只有2种氢, 烃A可能有的结构简式为。
用系统命名法命名下列有机物。
(1)CH3CH(C2H5)CH2CH2CH3;
(2)CH3CH(OH)CH(CH3)2;
(3) ;
;
硼元素在化学中有很重要的地位,硼及其化合物广泛应用于永磁材料、超导材料、富燃料材料、复合材料等高新材料领域。
(1)三氟化硼在常温常压下为具有刺鼻恶臭和强刺激性的无色有毒腐蚀性气体,其分子的立体构型为,B原子的杂化类型为。
(2)磷化硼是一种受到高度关注的耐磨涂料,它可用作金属的表面保护层。下图是磷化硼晶体的晶胞示意 图,则磷化硼的化学式为,该晶体的晶体类型是。
(3)硼酸(H3B03)是一种片层状结构的白色晶体,层内的H3B03分子间通过氢键相连(如图)。
①硼酸分子中B最外层有个电子,1 molH3B03的晶体中有mol氢键。
②硼酸溶于水生成弱电解质一水合硼酸B(OH)3·H2 O,它电离生成少量[B(OH)4]一和H+,则硼酸为元酸,[B(OH)4]一含有的化学键类型为。
(4)H3P04的K1、K2、K3分别为7.6×10-3、6.3×10-8、4.4×10-13,硝酸完全电离,而亚硝酸K=5.1×10-4, 请根据结构与性质的关系解释:
①H3PO4的K1远大于K2的原因;
②硝酸比亚硝酸酸性强的原因。
(5)NiO晶体结构与NaCl晶体类似,其晶胞的棱长为a cm,则该晶体中距离最近的两个阳离子核间的距离为(用含有a的代数式表示)。在一定温度下,NiO晶体可以自发地分散并形成“单分子层”(如图)
可以认为氧离子作密致单层排列,镍离子填充其中,列式并计算每平方米面积上分散的该晶体的质量为
g(氧离子的半径为1.40×10-10m,  1.732)。
1.732)。
Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的巨大作用。
(1)N位于周期表中第周期族,与N3-含有相同电子数的三原子分子的空间构型是。
(2)C、N、O三种元素的第一电离能由大到小的顺序为
(3)Cu+电子排布式为,其在酸性溶液中不稳定,可发生歧化反应生成Cu2+和Cu,但CuO在高温下会分解成Cu20,试从结构角度解释高温下CuO何会生成Cu2O:。
(4)在Cu的催化作用下,乙醇可被空气氧化为乙醛,乙醛分子中碳原子的杂化方式是,乙醛分子中H—C—O的键角(填“大于”“等于”或“小于”)乙醇分子中的H—C一0的键角。
(5)[Cu(H20)4]2+为平面正方形结构,其中的两个H20被Cl-取代有两种不同的结构,试画出[Cu(H20)2(C1)2]具有极性的分子的结构式:。
(6)Cu3N的晶胞结构如图,N3-的配位数为,Cu+半径为a pm,N3- 半径为b pm,Cu3N的密度为g·cm-3。(阿伏加德罗常数用NA表示)