实验室制备氯气的化学方程式如下:MnO2 + 4HCl(浓) MnCl2 + Cl2↑+ 2H2O
MnCl2 + Cl2↑+ 2H2O
(1)将该化学方程式改写成离子方程式: 。
(2)该反应中的还原剂是 ;氧化产物是 。
(3)若制得氯气11.2L(标准状况),则在反应过程中转移的电子数目约为 。
某水溶液中含有等物质的量浓度的Cu(NO3)2和MgCl2,对该溶液以惰性电极进行电解,分阶段写出电解反应的化学方程式。
第一阶段的反应:______________________________________________________________________;
第二阶段的反应:______________________________________________________________________。
(1)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度。则100℃时1 mol·L-1的NaOH溶液中,由水电离出的c(H+)=___________mol·L-1。25 ℃时,向水的电离平衡体系中加入少量NH4Cl固体,对水的电离平衡的影响是________(填“促进”、“抑制”或“不影响”)。
(2)电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。
| 化学式 |
电离平衡常数(25℃) |
| HCN |
K=4.9×10-10 |
| CH3COOH |
K=1.8×10-5 |
| H2CO3 |
K1=4.3×10-7、K2=5.6×10-11 |
①25℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,所得溶液显碱性,则c(Na+) ________
c(CH3COO-)(填“>”、“<”或“=”)。
②25℃时,有等浓度的①NaCN溶液、②Na2CO3溶液、③CH3COONa溶液,三种溶液的pH由大到小的顺序为___________。(填序号)
③向NaCN溶液中通入少量CO2,所发生反应的化学方程式为_________________________________。
结合下表回答下列问题:
| 物质 |
Fe(OH)2 |
Cu(OH)2 |
Fe(OH)3 |
| 溶度积/25℃ |
8.0×10-16 |
2.2×10-20 |
4.0×10-38 |
| 完全沉淀时的pH范围 |
≥9.6 |
≥6.4 |
3~4 |
(1)CuCl2溶液中含有少量的FeCl2和FeCl3,为得到纯净的CuCl2•2H2O晶体,可先加入适量氯水,发生的离子反应为:_________________________________;再加入_______________________,调至pH=4,此时溶液中的c(Fe3+)=__________。过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2•2H2O晶体。
(2)在空气中直接加热CuCl2•2H2O晶体得不到纯的无水CuCl2,由CuCl2•2H2O晶体得到纯的无水CuCl2的合理方法是___________________________________________。
已知某溶液中只存在OH-、H+、Na+、CH3COO-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
| A.c (CH3COO-)>c (Na+)>c (H+)>c (OH-) | B.c (CH3COO-)>c (Na +)>c (OH-)>c (H+) |
| C.c (CH3COO-)>c (H+)>c (Na+)>c (OH-) | D.c (Na+)>c(CH3COO-)>c (OH-)>c (H+) |
(1)这四组关系中有一组是不可能的,这组关系是(选填序号)。
(2)若该溶液只有一种溶质,上述离子浓度大小顺序关系中正确的是(选填序号)。
(3)若上述关系中C是正确的,则溶液中溶质的化学式是。
(4)若该溶液由体积相等的醋酸和NaOH溶液混合而成,且恰好呈中性,则:
混合前c(CH3COOH)c(NaOH)(填“>”、“<”、或“=”,下同);
混合后溶液中c(Na+)c(CH3COO-)。
如图所示,B中活塞可以自由滑动。A、B中均有1mol X、1mol Y,起始时,V(A)=V(B)=a L。关闭K,相同温度下,两容器中同时发生反应:2X(g)+2Y(g) Z(g)+2W(g) ΔH<0,达到平衡(Ⅰ)时,V(B)=0.8a L。
Z(g)+2W(g) ΔH<0,达到平衡(Ⅰ)时,V(B)=0.8a L。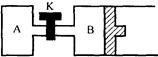
(1)达到平衡所需的时间:AB。(填“>”、“<”、或“=”,下同)
(2)W的百分含量:A B。
(3)B中X的转化率为。
(4)打开K,重新达平衡(Ⅱ)时,B的体积为L(用含a的式子表示,连通管体积忽略不计)。