X、Y、Z三种气体都是大气污染物,在工业上通常都用碱溶液吸。已知X是造成酸雨的主要物质;Y是一种单质,其水溶液具有漂白作用;Z是硝酸工业和汽车尾气中的有害物质之一,易溶于水。
(1)写出X、Y、Z的化学式:
X ; Y ; Z 。
(2)X能使湿润的红布条褪色,通过 方法能使布条颜色复原。
(3)写出下列有关反应的化学方程式:
X在一定条件下与氧气反应 。
Y与NaOH溶液反应 。
Z与水反应 。
某温度(t℃)时,水的Kw=10-13 mol2·L-2,则该温度(填大于、小于或等于) 25℃。将此温度下pH=11的NaOH溶液aL与pH=1的H2SO4的溶液bL混合,则:
(1)若所得混合液为中性,则a∶b;
(2)若所得混合液的pH=2,则a∶b;
298K时,合成氨反应的热化学方程式为:
N2(g)+3H2(g)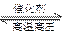 2NH3(g);△H=-92.4kJ·mol-1
2NH3(g);△H=-92.4kJ·mol-1
在该温度下,取1molN2和3molH2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量总是小于92.4 kJ是。
甲硅烷(SiH4)是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和水 ,常温下1g甲硅烷自燃放出的热量为44.6KJ,其热化学方程式为。
,常温下1g甲硅烷自燃放出的热量为44.6KJ,其热化学方程式为。
某烃类化合物A的质谱图表明其相 对分子质量为84,红外光谱表明分子
对分子质量为84,红外光谱表明分子 中含有碳碳双键,核磁共振谱表明分子中只有一种类型的氢。
中含有碳碳双键,核磁共振谱表明分子中只有一种类型的氢。
(1)A的结构简式为;
(2)A中的碳原子是否都处于同一平面?(填“是”或者“不是”);
(3)在下图中,D1、D2互为同分异构体,E1、E2互为同分异构体。
反应②的化学方程式为;C的化学名称为;E2的结构简式是;④、⑥的反应类型依次是
 。
。
汽油不仅是重要的燃料,而且是重要的化工原料,可以通过汽油裂解得到化工原料如乙烯等,还可以在催化剂作用下改变汽油分子的结构,由链烃变为芳香烃,这种变化叫做异构化。下面是以石油为原料发生的有机物的衍变关系图:
(已知:反应③,④中的原子利用率均为100%)
请回答下列问题:
(1)上述反应①~⑦中属于加成反应的有___________________(填序号,下
同),属于取代反应的有__________________。
(2)写出A,B的结构简式:A______________,B________________。
C的分子式为_________________。
(3)写出下列反应的化学方程式:
④________________________________________________________________;
⑦____________________ ____________________________________________。
____________________________________________。