元素的电负性的大小可以作为判断元素金属性与非金属性强弱的尺度。下表列出部分短周期元素的电负性。请回答下列问题。
| 元素 |
Al |
B |
Be |
C |
Cl |
X |
Li |
| 电负性 |
1.5 |
2.0 |
1.5 |
2.5 |
3.0 |
4.0 |
1.0 |
| 元素 |
Mg |
N |
Y |
O |
P |
S |
Si |
| 电负性 |
1.2 |
3.0 |
0.9 |
3.5 |
2.1 |
2.5 |
1.8 |
(1)根据上表给出的数据,可知元素的电负性越大,____(填“金属性”或“非金属性”)越强。
(2)推测Y 为____(填元素符号),用电子式表示X元素与Y元素的化合物的形成过程____________。
用一种试剂除去下列各物质中的杂质(括号内为杂质),并写出反应的离子方程式。
(1)FeSO4(CuSO4):
所需试剂(填化学式),所涉及的离子方程式:。
(2)O2(CO2):
所需试剂(填化学式),所涉及的离子方程式:。
(1)用标准NaOH溶液滴定未知浓度的盐酸,用酚酞作指示剂,下列操作中会导致实验结果偏低的是。
①碱式滴定管用蒸馏水洗净后没有用标准液润洗
②用酸式滴定管加待测液时,刚用蒸馏水洗净后的滴定管未用待测液润洗
③锥形瓶用蒸馏水洗净后没有用待测液润洗
④滴定前滴定管尖端有气泡,滴定后气泡消失
⑤终点读数时俯视,其他读数方法正确
(2)有一学生在实验室测某溶液的pH。实验时他先用蒸馏水湿润pH试纸,然后用洁净的玻璃棒蘸取试样进行检测。
①该学生的操作(填“正确”或“不正确”),如不正确,请分析是否一定有误差 并说明理由(若正确则此问不用作答)
并说明理由(若正确则此问不用作答)
。
②若按此法分别测定c(H+)相等的盐酸和醋酸溶液的pH,误差较大的是,原因是。
某化学兴趣小组拟用粗氧化铜(含少量铜粉、氧化铁及不溶于酸的杂质)制取
无水氯化铜,其制备步骤如下: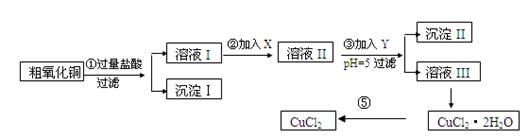
实验过程中所用的物质X,Y及pH控制参照下表确定:
表I
| 物质 |
开始沉淀时pH |
完全沉淀时pH |
| Fe(OH)3 |
2.7 |
3.7 |
| Fe(OH)2 |
7.6 |
9.6 |
| Cu(OH)2 |
5.2 |
6.4 |
表Ⅱ
| 氧化剂 |
调节pH的物质 |
||
| A |
双氧水 |
D |
氨水 |
| B |
高锰酸钾 |
E |
碱式碳酸铜 |
| C |
氯水 |
F |
氧化铜 |
请填写下列空白
(1)沉淀Ⅱ的成分(化学式)是。
(2)步骤②加入的试剂X可选用表Ⅱ中的(填序号),其作用是。
(3)步骤③加入的试剂Y可选用表Ⅱ中的(填序号),控制pH=5的目的是。
(4)步骤⑤要得到无水CuCl2,应控制的条件是。
(5)步骤①中所发生的全部反应的离子方程式:
。
(1)某温度下纯水中c(H+) = 2×10-7 mol/L,则此时水中的C(OH-) =mol/L,若温度不变,向水中滴入稀盐酸使C(H+) = 5×10-6 mol/L,则此时溶液中的c(OH-) = __ mol/L,滴入盐酸后水的离子积(填“变大”“变小”或“不变”,下同),水的电离度。
(2)今有A、 CH3COOH; B、 HCl;C、 H2SO4三种溶液,
①当它们pH相同时,其物质的量浓度关系是(用字母表示, 下同);
下同);
②体积和物质的量浓度相同的三种溶液,分别与同浓度的烧碱溶液反应,要使反应后的溶液呈中性,所需烧碱溶液的体积关系为;
③当它们pH相同、体积相同时,分别加入足量锌,相同状况下产生气体体积关系为。
高炉炼铁过程中发生的主要反应为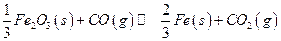
已知该反应在不同温度下的平衡常数如下:
请回答下列问题:
(1)该反应的平衡常数表达式K =_____________,△H______0(填“>”、“<”或“=”);
=_____________,△H______0(填“>”、“<”或“=”);
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过l0 min后达到平衡。求该时间范围内反应的平均反应速率
υ(CO2)= _____________、CO的平衡转化率= ___________;
(3)欲提高(2)中CO的平衡转化率,可采取的措施是__________。
| A.减少Fe的量 | B.增加Fe2O3的量  |
C.移出部分CO2 |
| D.提高反应温度 E.减小容器的容积 F.加入合适的催化剂 |