(1)某温度下纯水中c(H+) = 2×10-7 mol/L,则此时水中的C(OH-) = mol/L,若温度不变,向水中滴入稀盐酸使C(H+) = 5×10-6 mol/L,则此时溶液中的c(OH-) = _ _ mol/L,滴入盐酸后水的离子积 (填“变大”“变小”或“不变”,下同),水的电离度 。
(2)今有A、 CH3COOH ; B、 HCl ;C、 H2SO4三种溶液,
①当它们pH相同时,其物质的量浓度关系是 (用字母表示, 下同);
下同);
②体积和物质的量浓度相同的三种溶液,分别与同浓度的烧碱溶液反应,要使反应后的溶液呈中性,所需烧碱溶液的体积关系为 ;
③当它们pH相同、体积相同时,分别加入足量锌,相同状况下产生气体体积关系为 。
(选做题12分)
以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略):
Ⅰ.从废液中提纯并结晶出FeSO4·7H2O。
Ⅱ.将FeSO4·7H2O配制成溶液。
Ⅲ.FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeC03的浊液。
Ⅳ.将浊液过滤,用90℃热水洗涤沉淀,干燥后得到FeC03固体。
ⅴ.煅烧FeCO3,得到Fe2O3固体。
已知:NH4HCO3在热水中分解。
(1)Ⅰ中,加足量的铁屑除去废液中的Fe3+,该反应的离子方程式是。
(2)Ⅱ中,需加一定量硫酸。运用化学平衡原理简述硫酸的作用。
(3)Ⅲ中,生成FeCO3的离子方程式是。若FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式。
(4)IV中,通过检验SO42-来判断沉淀是否洗涤干净。检验SO42的操作是。
(5)已知煅烧FeC03的化学方程式是4FeCO3+O2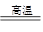 2Fe2O3+4CO2。现煅烧464.0 kg的FeCO3,得到316.8 kg产品。若产品中杂质只有FeO,则该产品中Fe2O3的质量是Kg。(摩尔质量/g·mol-1:FeCO3 116 Fe2O3 160 FeO 72)
2Fe2O3+4CO2。现煅烧464.0 kg的FeCO3,得到316.8 kg产品。若产品中杂质只有FeO,则该产品中Fe2O3的质量是Kg。(摩尔质量/g·mol-1:FeCO3 116 Fe2O3 160 FeO 72)
(1)某温度下,纯水中 [H+]=2.0×10-7 mol/L,则此时[OH-] =mol/L,水的离子积Kw=;相同条件下,测得①Na2CO3(aq)②CH3COONa(aq)③NaClO(aq)三种稀溶液的pH值相同。那么,它们的物质的量浓度由大到小的顺序是。(填序号)
(2)pH值相同的 HCl(aq)、H2SO4(aq)、 CH3COOH(aq)各100 mL
①三种溶液中物质的量浓度最大的是;
②分别用0.1 mol/L的NaOH(aq)中和,消耗NaOH(aq)的体积分别为V1、V2、V3,它们由大到小的顺序是。
③反应开始时,反应速率。(填
| A.HCl最快; | B.H2SO4最快; | C.CH3COOH最快; | D.一样快) |
(3)0.020 mol/L的HCN(aq)与0.020 mol/L NaCN(aq)等体积混合,已知该混合溶液中c (Na+) > c( CN-),用“>、<、=”符号填空
①溶液中c (OH-)c (H+)②c (HCN)c (CN-)
在25mL 0.1 mol·L-1的NaOH溶液中逐滴加入0.2 mol·L-1的CH3COOH溶液,溶液pH变化曲线如图所示。
(1)B点溶液呈中性,有人据此认为,在B点时NaOH溶液与CH3COOH溶液恰好完全反应,这种看法是否正确?(填“是”或“否”),如果不正确,则二者恰好完全反应的点是在(填“AB”、“BC”或“CD”)区间内。
(2)在D点时,溶液中c(CH3COO-)+c(CH3COOH)2c(Na+)(填“>”、“<”或“=”)。
(3)在C点,溶液中离子浓度由大到小的顺序为:。
下表是不同温度下水的离子积数据:
| 温度/℃ |
25 |
t1 |
t2 |
| Kw/ mol2·L-2 |
1×10-14 |
a |
1×10-12 |
试回答以下几个问题:
(1)若25< t1< t2,则a1×10-14(填“<”、“>”或“=”),由此判断的理由是:
。
(2)在t1℃下,pH=10的NaOH溶液中,水电离产生的[OH-]为:。
(3)在t2℃下,将pH=11的苛性钠溶液V1 L与pH=1的硫酸溶液V2 L混合(设混合后溶液体积为原两溶液体积之和)所得溶液的pH=2,则V1︰V2 =,此溶液中各种离子的浓度由大到小的顺序是。
已知几种难溶电解质的溶度积如下表所示:
| 几种难溶电解质的Ksp(25℃) |
|
| 沉淀溶解平衡 |
Ksp |
 AgBr(s) Ag+(aq)+Br-(aq) AgBr(s) Ag+(aq)+Br-(aq) |
5,0×10-13mol2·L-2 |
 AgI(s) Ag+(aq)+I-(aq) AgI(s) Ag+(aq)+I-(aq) |
8.3×10-17mol2·L-2 |
 FeS(s) Fe2+(aq)+S2-(aq) FeS(s) Fe2+(aq)+S2-(aq) |
6.3×10-18mol2·L-2 |
 ZnS(s) Zn2+(aq)+S2-(aq) ZnS(s) Zn2+(aq)+S2-(aq) |
1.6×10-24mol2·L-2 |
 CuS(s) CuS(s) Cu2+(aq)+S2-(aq) Cu2+(aq)+S2-(aq) |
1.3×10-36mol2·L-2 |
(1)AgBr、AgI、FeS、ZnS、CuS的溶解能力由大到小的顺序为:。
(2)向饱和的AgI溶液中加入固体硝酸银,则[I-](填“增大”、“减小”或“不变”),若改加AgBr固体,则[Ag+](填“增大”、“减小”或“不变”)。
(3)在25℃时,向100mL浓度均为0.1 mol·L-1 FeCl2、ZnCl2、CuCl2的混合溶液中逐滴加入Na2S溶液,生成的沉淀的先后顺序是(用沉淀物的化学式表示)。
(4)在25℃时,把ZnS加入蒸馏水中,一定时间后达到如下平衡:ZnS(s)  Zn2+(aq)+S2-(aq),下列措施可使ZnS减少的是
Zn2+(aq)+S2-(aq),下列措施可使ZnS减少的是
A.加入少量CuS固体B.加入少量FeS固体
C.加入少量FeCl2固体D.加入少量CuCl2固体