已知几种难溶电解质的溶度积如下表所示:
| 几种难溶电解质的Ksp(25℃) |
|
| 沉淀溶解平衡 |
Ksp |
 AgBr(s) Ag+(aq)+Br-(aq) AgBr(s) Ag+(aq)+Br-(aq) |
5,0×10-13mol2·L-2 |
 AgI(s) Ag+(aq)+I-(aq) AgI(s) Ag+(aq)+I-(aq) |
8.3×10-17mol2·L-2 |
 FeS(s) Fe2+(aq)+S2-(aq) FeS(s) Fe2+(aq)+S2-(aq) |
6.3×10-18mol2·L-2 |
 ZnS(s) Zn2+(aq)+S2-(aq) ZnS(s) Zn2+(aq)+S2-(aq) |
1.6×10-24mol2·L-2 |
 CuS(s) CuS(s) Cu2+(aq)+S2-(aq) Cu2+(aq)+S2-(aq) |
1.3×10-36mol2·L-2 |
(1)AgBr、AgI、FeS、ZnS、CuS的溶解能力由大到小的顺序为: 。
(2)向饱和的AgI溶液中加入固体硝酸银,则[I-] (填“增大”、“减小”或“不变”),若改加AgBr固体,则[Ag+] (填“增大”、“减小”或“不变”)。
(3)在25℃时,向100mL浓度均为0.1 mol·L-1 FeCl2、ZnCl2、CuCl2的混合溶液中逐滴加入Na2S溶液,生成的沉淀的先后顺序是 (用沉淀物的化学式表示)。
(4)在25℃时,把ZnS加入蒸馏水中,一定时间后达到如下平衡:ZnS(s)  Zn2+(aq)+S2-(aq),下列措施可使ZnS减少的是
Zn2+(aq)+S2-(aq),下列措施可使ZnS减少的是
A.加入少量CuS固体 B.加入少量FeS固体
C.加入少量FeCl2固体 D.加入少量CuCl2固体
现有常见金属单质A、B 和气体甲、乙、丙及物质C、D,它们之间存在如下转化关系(图中有些反应的产物和反应的条件没有全部标出)。回答下列问题: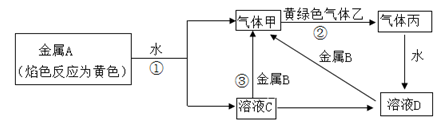
①写出金属B和气体甲的化学式:B,甲;
②黄绿色气体乙可以制漂白液和漂白粉,写出制漂白液的离子方程式
;漂白液的有效成分是。
0.5mol NH4Cl的质量是g,含有H原子mol,将此0.5mol NH4Cl与足量消石灰共热反应可制得NH3 L(标准状况下),用法收集产生的NH3,可用靠近集气瓶口,若则氨气已收集满。
实验室为了防止FeCl2溶液变质,通常向该溶液的试剂瓶中加入适量的粉,取适量FeCl2溶液于试管中,滴入适量的NaOH溶液产生色絮状沉淀,继而迅速的变为色,最后变为色的(写化学式)沉淀。
合金的硬度一般比它的各成分金属的,合金的熔点一般比它的各成分金属的,我国使用最早的合金是。
工业上电解饱和食盐能制取多种化工原料,其中部分原料可用于制备多晶硅。
(1)下图是离子交换膜法电解饱和食盐水示意图,电解槽阳极产生的气体是;NaOH溶液的出口为(填字母);精制饱和食盐水的进口为(填字母);干燥塔中应使用的液体是。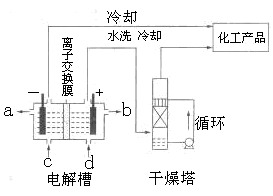
(2)多晶硅主要采用SiHCl3还原工艺生产,其副产物SiCl4的综合利用受到广泛关注。
① SiCl4可制气相白炭黑(与光导纤维主要原料相同),方法为高温下SiCl4与H2和O2反应,产物有两种,化学方程式为。
② SiCl4可转化为SiHCl3而循环使用。一定条件下,在20L恒容密闭容器中的反应:
3 SiCl4(g)+2H2(g)+Si(s) 4SiHCl3(g)
4SiHCl3(g)
达平衡后,H2与SiHCl3物质的量浓度分别为0.140mol/L和0.020mol/L,若H2全部来源于离子交换膜法的电解产物,理论上需消耗纯NaCl的质量为 ______kg。
(3)采用无膜电解槽电解饱和食盐水,可制取氯酸钠,同时生成氢气,现制得氯酸钠213.0kg,则生成氢气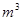 (标准状况)。
(标准状况)。