在450℃并有催化剂存在下,在体积为1L的密闭恒温容器中,二氧化硫和氧气发生如下反应:2SO2+ O2  2SO3
2SO3 
(1)已知:64g SO2完全转化为SO3会放出85kJ热量。 SO2转化为SO3的热化学方程式是 。
(2)该反应的化学平衡常数表达式K= 。
(3)降低温度,化学反应速率 。该反应K值将 。(填“增大”或“减小”或“不变”)
(4)450℃时,在一密闭容器中,将二氧化硫与氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间段是 。
a.10-15min b.15-20min c.20-25min d.25-30min
(5)据图判断,10min到15min的曲线变化的原因可能是 (填写编号)。
a.增加SO3的物质的量 b.增大容器体积 c.降低温度 d.催化剂
(6)在15分钟时,SO2的转化率是 。
如图所示,甲、乙两装置电极材料都是铁棒与碳棒,请回答下列问题:
(1)若两装置中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲装置中的棒,乙装置中的棒。
②乙装置中阳极的电极反应式是:。
(2)若两装置中均为饱和NaCl溶液:
①写出乙装置中总反应的离子方程式:。
②甲装置中碳极的电极反应式是,乙装置碳极的电极反应属于(填“氧化反应”或“还原反应”)。
③将湿润的淀粉KI试纸放在乙装置碳极附近,发现试纸变蓝,解释其原因:。
合成氨工业对国民经济和社会发展具有重要的意义。其原理为:
N2(g)+3H2(g)  2NH3(g) ΔH=-92.4 kJ/mol,据此回答以下问题:
2NH3(g) ΔH=-92.4 kJ/mol,据此回答以下问题:
(1)①该反应的化学平衡常数表达式为K=。
②根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越。
(2)某温度下,若把10 mol N2与30 mol H2置于体积为10 L的密闭容器内,反应达到平衡状态时,测得混合气体中氨的体积分数为20%,则该温度下反应的K=(可用分数表示)。能说明该反应达到化学平衡状态的是(填字母)。
a.容器内的密度保持不变
b.容器内压强保持不变
c.v正(N2)=2v逆(NH3)
d.混合气体中c(NH3)不变
(3)对于合成氨反应而言,下列有关图像一定正确的是(选填序号)。
已知室温时,0.1 mol/L某一元酸HA在水中有0.1%发生电离,回答下列问题:
(1)该溶液中c(H+)=。
(2)HA的电离平衡常数K=;
(3)升高温度时,K(填“增大”,“减小”或“不变”)。
(4)由HA电离出的c(H+)约为水电离出的c(H+)的倍。
(1)某反应过程中的能量变化如图所示: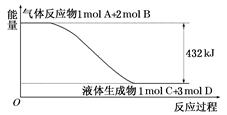
写出该反应的热化学方程式:。
(2)0.3 mol气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5 kJ的热量,其热化学方程式为。
如图所示,p、q为直流电源的两极,A由金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D上产生气泡,试回答: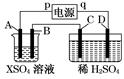
(1)p为极,A极发生了反应。
(2)C为极,可收集到;D为极,可收集到。
(3)C极的电极反应式为。
(4)在电解过程中,测C、D两极上产生气体的体积,实验数据如下表:
| 时间(min) |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
| 阴极产生气体 的体积(cm3) |
6 |
12 |
20 |
29 |
39 |
49 |
59 |
69 |
79 |
89 |
| 阳极产生气体 的体积(cm3) |
2 |
4 |
7 |
11 |
16 |
21 |
26 |
31 |
36 |
41 |
仔细分析以上实验数据,请说出变化的可能原因是
。
(5)当反应进行一段时间后,A、B电极附近溶液的pH(填“增大”“减小”或“不变”)。
(6)当电路中通过0.004 mol电子时,B极上沉积的金属X为0.128 g,则此金属的摩尔质量为。