(1)美国的探月飞船“阿波罗号”使用的就是氢氧燃料电池,电解液为KOH溶液,已知正极反应式为O2+2H2O+4e-=4OH-,则负极反应式为: ;
(2)用锌片、铜片连接后浸入稀硫酸溶液中,构成了原电池,写出正极电极反应式: ;工作一段时间,锌片的质量减少了3.25克,铜表面导线中通过 ____ mol电子。
工业盐中含有NaNO2,外观和食盐相似,有咸味,人若误食会引起中毒,致死量为0.3g—0.5g.已知NaNO2能发生如下反应:aNO +xI—+yH+=bNO↑+cI2+zH2O,
+xI—+yH+=bNO↑+cI2+zH2O,
请回答下列问题:
(1)上述反应中,x、y、z的数值分别是(全对才给分),
(2)根据上述反应,可用化学试纸和生活中常见物质进行实验来鉴别工业盐和食盐,现有碘化钾淀粉试纸,则还需选用的生活中常见物质的名称为.
(3)某工厂废切削液中含有2%—5%的NaNO2,直接排放会造成水污染,但加入下列物质中的某一种就能使NaNO2转化为不引起污染的N2,该物质是,
a.NaCl b.H2O2c.NH4Cl d.浓H2SO4
所发生反应的离子方程式为:.
A~G各物质间的关系如下图,其中B、D为气态单质.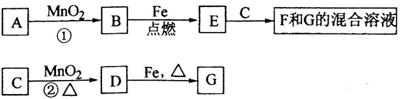
请回答下列问题:
(1)填写物质E的一个俗名_______________________;
(2)可选用不同的A进行反应①,若必须在加热下进行,其化学方程式为_____________;
(3)反应②的化学方程式为___________________________________________________;
(4)C、F、G的溶液通入B可转变成一种单一溶质水溶液,试写出该反应的离子方程式__________检验该溶液中阳离子的常用试剂是____________.

德国和美国科学家首先制出由20个碳原子组成的空心笼状分子C20,该笼状结构是由许多正五边形构成(如右图)。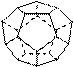
请回答: C20分子共有_______个正五边形,共有_______条棱边,C20晶体属于_______ (填晶体类型).
四种元素X、Y、Z、W位于元素周期表的前四周期,已知它们的核电荷数依次增加,且核电荷数之和为51;Y原子的L层p轨道中有2个电子;Z与Y原子的价层电子数相同;W原子的L层电子数与最外层电子数之比为4︰1,其d轨道中的电子数与最外层电子数之比为5︰1。
(1)Y、Z可分别与X形成只含一个中心原子 的共价化合物a、b,它们的分子
的共价化合物a、b,它们的分子
式分别是、;杂化轨道分别是、;a分子的
立体结构是。
(2)Y的最高价氧化物和Z的最高价氧化物的晶体类型分别是晶体、
晶体。
(3)X的氧化物与Y的氧化物中,分子极性较小的是(填 分子式)。
分子式)。
(4)Y与Z比较,电负性较大的是。
(5)W的元素符号是,其+2价离子的核外电子排布式是。