有A、B、C、D、E五种溶液,它们均不含相同的阴、阳离子。已知其阴、阳离子的范围是:Ag+、Na+、Ba2+、Al3+、Fe3+、Cl-、 、OH-、
、OH-、 、
、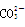 。
。
现进行如下实验:
①C溶液中加入纯铁粉,溶液的质量增加。
②A、E溶液都为碱性,测得浓度均为0.1 mol/L的A、E溶液的pH,A溶液的pH小于E。
③在B溶液中逐滴加入氨水,开始出现沉淀,继续加氨水,沉淀消失。
④在D溶液中加入Ba(NO3)2溶液,无明显变化。
(1)由上述现象可推知各溶液中所含阴、阳离子为:
| 溶液 |
A |
B |
C |
D |
E |
| 阳离子 |
|
|
|
|
|
| 阴离子 |
|
|
|
|
|
(2)写出实验①和③中反应的离子方程式。
(1)下列五种物质中①Ne ②H2O ③NH3④KOH ⑤Na2O,只存在共价键的是,只存在离子键的是,既存在共价键又存在离子键的是,不存在化学键的是。(填写序号)
(2)在下列变化中,①碘的升华 ②烧碱熔化 ③MgCl2溶于水 ④HCl溶于水⑤O2溶于水,未发生化学键破坏的是,仅发生离子键破坏的是,仅发生共价键破坏的是。(填写序号)
用如图所示装置可以收集以下几种气体(烧瓶位置不动)(填字母,下同);
①H2②SO2③CH4④ HCl ⑤ NH3⑥ NO⑦H2S
(1)若烧瓶是干燥的,则由A口进气,可收集到的气体有,由B口进气,可收集的气体有。
(2)若在烧瓶中充满水,可收集的气体有,气体由口进入。
(3)若此装置用于净化气体,在烧瓶内装有洗涤液,则混合气体应由口进入。
在下列事实中,什么因素影响了化学反应速率?
①天的食品易霉变,冬天就不易发生该现象。
②熔化的氯酸钾放出气泡较慢,撒入少量二氧化锰很快产生气体。
③工业上常将固体燃料粉碎,以提高燃烧效率。
④同体积、同浓度的盐酸与同样大小的锌条和镁条反应,产生气体前慢后快。
⑤同体积、同浓度的硫酸和盐酸与同样大小质量相等的锌粒反应,产生气体前者快。
在2 L密闭容器中,800 ℃时反应2NO(g)+O2(g)  2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
| 时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)/mol |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |

(1)A点处,v(正)________v(逆),A点正反应速率________B点正反应速率(用“大于”、“小于”或“等于”填空)。
(2)如图中表示NO2的变化的曲线是________。用O2表示从0~2 s内该反应的平均速率v=________________。
(3)能说明该反应已经达到平衡状态的是________。
a.v(NO2)=2v(O2)b.容器内压强保持不变
c.v逆(NO)=2v正(O2)d.容器内的密度保持不变
(4)能使该反应的反应速率增大的是________。
a.及时分离出NO2气体b.适当升高温度
c.增大O2的浓度d.选择高效的催化剂
在一体积为10 L的容器中,通过一定量的CO和H2O,850 ℃时发生反应:
CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)
(1)CO和H2O浓度变化如图,则0~4 min的平均反应速率v(CO)=______mol·L-1·min-1。
(2)如图中4~5min之间该反应________(填“是”或“否”)处于平衡状态,判断理由________________________________________________________________________。