Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
【实验设计】控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表)。设计如下对比实验。
(1)请完成以下 实验设计表(请填满表中空缺地方,表中不要留空格)。
实验设计表(请填满表中空缺地方,表中不要留空格)。
| 实验编号 |
实验目的 |
T/K |
pH |
 c/10-3mol·L-1 c/10-3mol·L-1 |
|
| H2O2 |
Fe2+ |
||||
| ① |
为以下实验做参照 |
298 |
3 |
6.0 |
0.30 |
| ② |
探究温度对降解反应速率的影响 |
|
|
|
|
| ③ |
|
298 |
10 |
6.0 |
0.30 |
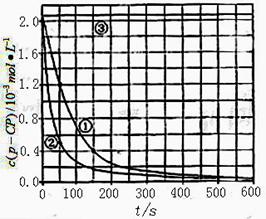
【数据处理】实验测得p-CP的浓度随时间变化的关系如右上图。
(2)请根据右上图实验①曲线,计算降解反应在50 -150 内的反应速率ν(p-CP )=
内的反应速率ν(p-CP )=
【解释与结论】
(3)实验①②表明温度升高,降解反应速率增大。但 温度过高时反而导致降解反应速率减小,请从Fenton法所使用试剂H2O2的角度分析原因: ;
温度过高时反而导致降解反应速率减小,请从Fenton法所使用试剂H2O2的角度分析原因: ;
(4)实验③得出的结论是:pH=10时, ;
【思考与交流】
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来,根据上图中信息,给出一种迅速停止反应的方法:  。
。
合成高分子材料用途广泛、性能优异,其功能与分子结构有密切的关系。下面是几种高分子材料的结构简式:
(1)A是天然橡胶的主要成分,易老化,A中含有的官能团的名称是____________。
(2)B的单体是苯酚和___________,这两种单体在碱催化下,可得到网状高分子化合物,俗称电木,是热固性塑料。
(3)C与NaOH溶液在一定条件下反应,生成高吸水性树脂,该树脂的结构简式是___________________________________。
(4)D是合成纤维中目前产量第一的聚酯纤维——涤纶,可由两种单体在一定条件下合成,该合成反应的两种单体是________________。
请根据官能团的不同对下列有机物进行分类:
(1)属于芳香烃的;(2)属于醇类的有;
(3)含有醛基的有;(4)属于羧酸的有。
目前世界上60%的镁是从海水提取的。海水提镁的主要流程如下:
提示: ①MgCl2晶体的化学式为MgCl2•6H2O;
②MgO的熔点为2852℃,无水MgCl2的熔点为714℃。
(1)操作①的名称是 , 操作②的名称、、过滤。
(2)试剂a的名称是。
(3)用氯化镁电解生产金属镁的化学方程式为:。
(4)工业上是将氢氧化镁转变为氯化镁,再电解氯化镁来制取镁单质;而不采用:加热Mg(OH)2得到MgO,再电解熔融MgO的方法制金属镁,其原因是 。
(12分)乙烯是重要化工原料,其产量是一个国家石油化工水平的标志。通过石油裂解可以获得乙烯,再以乙烯为原料还可以合成很多的化工产品。已知乙烯能发生以下转化:
(1)乙烯的结构简式为 。
(2)反应①的反应类型是,D中含官能团名称为。
(3)写出以下反应的化学方程式:
①;②;
③。
(14分)下面是元素周期表的一部分。据A至H在周期表中位置,请回答下列问题:
| A |
|||||||||||||||||
| E |
G |
||||||||||||||||
| B |
C |
D |
F |
H |
|||||||||||||
(1)F元素处于周期表中周期族。
以下请用元素符号或化学式填空:
(2)原子半径最大的是, A分别与E、F、G、H形成的化合物中,最稳定的化合物是。
(3)最高价氧化物是两性氧化物的是,最高价氧化物对应的水化物碱性最强的是,最高价氧化物对应水化物的酸性最强的是。
(4)C与H形成的化合物中含有(填“共价”或“离子”)键;用电子式表示C、H形成化合物的过程。