同温同压下,某瓶充满氧气时质量为116g,充满二氧化碳时,质量为122g,充满气体A时质量为114g,A的摩尔质量为________。
二甘醇又称乙二醇醚,分子式为C4H10O3(HO-CH2-CH2-O-CH2-CH2-OH),二甘醇是一种重要的化工原料,可以制取酸、酯、胺等,用途十分广泛。二甘醇一般的合成路线如下:
过程Ⅰ Br2条件Ⅱ反应Ⅲ
(1)过程Ⅰ是石油加工中常用步骤,其名称为 ;从物质B到物质C的反应条件Ⅱ是 ,该反应属于 (填写反应类型);物质B到物质C的过程如果条件控制不好会生成物质E,E可用于金属的切割,写出B可能生成E的化学方程式 。
(2)写出上述合成路线中的物质A、B、C的结构简式:
A ;B ;C
(3)反应Ⅲ的化学方程式为: 。
已知反应:3I-(aq)+S2O82-(aq)  I3-(aq)+2SO42-(aq)+Q
I3-(aq)+2SO42-(aq)+Q
(1)写出反应的平衡常数表达式:K=。
(2)如图表示反应过程中有关物质的能量,则反应过程中的Q0(填>、<、=);(I)、(II)两曲线中,使用催化剂的是曲线。
(3)反应的速率可以用I3-与加入的淀粉溶液反应显蓝色的时间t来度量,t越小,反应速率越大。下表是在20℃进行实验时所记录的数据
| 实验编号 |
① |
② |
③ |
④ |
⑤ |
| c(I-)/mol·L-1 |
0.040 |
0.080 |
0.080 |
0.160 |
0.160 |
| c(S2O82-)/mol·L-1 |
0.040 |
0.040 |
0.080 |
0.080 |
0.040 |
| t/s |
88 |
44 |
22 |
11 |
t1 |
从表中数据分析,该实验的目的是;
表中显色时间t1=s;最终得出的结论是。
硝酸盐受热分解的产物与硝酸盐的组成以及受热的温度等因素有关。
Ⅰ.一定条件下硝酸铵受热分解的化学反应方程式为:NH4NO3→HNO3+N2 +H2O(未配平)
(1)该反应中发生还原反应的过程是_______→________。
(2)反应中被氧化与被还原的氮原子数之比为__________;现有1mol NH4NO3分解,生成的氧化产物的物质的量是mol。
Ⅱ.硝酸铵受撞击或高温发生爆炸的化学反应方程式为:m NH4NO3→n O2+p N2+q H2O
(3)下列关于该方程式中化学计量数的说法正确的是_________(选填字母编号)。
a.m=1 b.n=2 c.p=3 d.q=4
(4)若反应过程中共转移3.01×1023个电子,则反应可产生气体的体积为_____(标准状况)。
I.尼泊金丙酯( )已被国家质量监督检验检疫总局禁止作为食品添加剂使用,下列关于它的说法错误的是。
)已被国家质量监督检验检疫总局禁止作为食品添加剂使用,下列关于它的说法错误的是。
| A.在核磁共振氢谱中能出现6组峰 |
| B.一定条件下,1 mol该物质能与4 mol H2发生加成反应 |
| C.与NaOH溶液反应,1 mol该物质最多消耗1 mol NaOH |
| D.最多有10个碳原子共平面 |
Ⅱ.合成高分子树脂F的路线如下图所示:
已知:
回答下列问题:
(1)A中官能团的名称为。
(2)B→C的反应类型为。
(3)C的结构简式为。
(4)写出E→F反应的化学方程式。
(5)已知碳碳双键能被O2氧化,则上述流程中“B→C”和“D→E”两步共同所起的作用是。
I.下列说法中正确的是。
| A.第一电离能由大到小的顺序为O>N>C |
B.由于C 和O 和O 互为等电子体,所以可以推断O 互为等电子体,所以可以推断O 的电子式为 的电子式为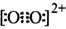 |
| C.根据岩浆晶出规则,Ca0比Mg0更容易在岩浆冷却过程中先结晶 |
| D.液态HF通常也可以写成(HF)n的形式,是因为液态HF分子间存在氢键 |
Ⅱ.(1)兰聚氰胺分子的结构简式如图所示,则其中氮原子轨道杂化类型是,l mol三聚氰胺分子中含mol 键。
键。 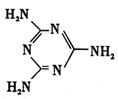
(2)某元素位于第四周期VIII族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,则其基态原子的M层电子排布式为____。
(3)过渡金属配合物Ni( CO)n的中心原子价电子数与配体提供电子总数之和为18,则n=____。
(4)碳化硅的晶胞结构(如右图)与金刚石类似(其中“●”为碳原子,“○”为硅原子)。图中“●”点构成的堆积方式与下列图式中所表示的堆积方式相同。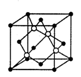
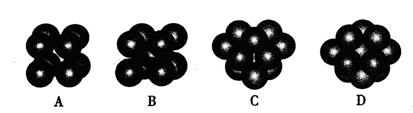
(5)碳化硅的结构中,与碳原子距离最近且相等的碳原子有个。设晶胞边长为a cm,碳原子直径为b cm,硅原子直径为c cm,则该晶胞的空间利用率为(用含a、b、c的式子表示)。