现有反应:mA(g)+nB(g)pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应为 热反应,且m+n p(填“>”、“=”“<”)。
(2)减压时,A的质量分数 (填“增大”“减小”或“不变”)。
(3)若加入B(体积不变 ),则A的转化率 (填“增大”“减小”或“不变”)。
),则A的转化率 (填“增大”“减小”或“不变”)。
(4)若升高温度,则平衡时B、C的浓度之比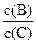 将 (填“增大”“减小”或“不变”)。
将 (填“增大”“减小”或“不变”)。
(5)若加入催化剂,平衡时气体混合物的总物质的量 (填“增大”“减小”或“不变”)。
(6)若B是有色物质,A、 C均无色,则加入C(体积不变)时混合物颜色 (填“变深”、“变浅”或“不变”);而维持容器内压强不变,充入氖气时,混合物颜色 (填“变深”、“变浅”或“不变”)。
氯化铜晶体(CuCl2·2H2O)中含有FeCl2杂质,为制得纯净的氯化铜晶体,首先将其制成水溶液,再按下图所示的操作步骤进行提纯。
请参照下表给出的数据填空。
| 氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
| Cu2+ |
4.7 |
6.7 |
| Fe2+ |
7.0 |
9.0 |
| Fe3+ |
1.9 |
3.2 |
⑴操作I加入X的目的是___________________________ 。
⑵下列物质都可以作为X,适合本实验的X物质可以是(填选项)_________ 。
A、KMnO4B、H2O2C、NaClO D、Cl2
⑶操作II的Y试剂为_______________(填化学式),并调节溶液的pH在______范围。
⑷实验室在配制CuCl2溶液时需加入少许盐酸的理由是(文字叙述并用有关离子方程式表示)__________________________________________________________。
⑸若将CuCl2溶液蒸干灼烧,得到的固体是_________________(填化学式);若要得无水CuCl2,请简述操作方法______________________________________________。
有A、B、C、D四种元素,A元素形成的-2价阴离子比氦的核外电子数多8个。B元素的一种氧化物为淡黄色固体,该固体遇到空气能生成A的单质。C为原子核内有12个中子的二价金属,当2.4gC与足量盐酸反应时,在标准状态下放出氢气2.24L。D的M层上有7个电子。
(1) A、B、各是什么元素?AB
(2)写出C的原子结构示意图:C
写出D的氢化物的电子式:
(3) 写出B、D最高价氧化物的水化物化学式:BD
(4)比较D的气态氢化物与H2S和HF的稳定性 ,理由是。
磺化煤(表达式为NaR)是一种钠离子型离子交换剂,它能与硬水中的Ca2+、Mg2+交换而将其除去,从而使水软化。现代海水的淡化方法是使海水按顺序通过两种离子交换剂,其流程如图所示。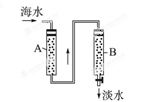
(1)现有氢型阳离子交换树脂(HR)和羟型阴离子交换树脂(ROH),则在图中的离子交换柱中应分别装入的离子交换树脂是(填表示式):A柱为______ ______,B柱为____________。
(2)说明上述顺序的理由_______________________________________________。
2003年6月在重庆市万州区发生的用“毛发水”勾兑酱油达61吨的恶性事件,此事引起国务院的高度重视。“毛发水”主要成分是胱氨酸,是应处理排放的废液。胱氨酸结构如下: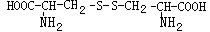
(1)写出胱氨酸的分子式:_________。
(2)胱氨酸可水解生成一种重要的半胱氨酸,美国科学家发现半胱氨酸能增强艾滋病毒感染者的免疫力,对控制艾滋病毒的蔓延有奇效。已知半胱氨酸的结构简式为: ,则下列说法错误的是
,则下列说法错误的是
| A.半胱氨酸属于α—氨基酸 |
| B.半胱氨酸是一种两性化合物 |
C.两分子半胱氨酸脱水形成的二肽结构简式为: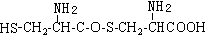 |
D.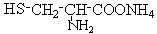 可与NaOH溶液反应放出一种碱性气体 可与NaOH溶液反应放出一种碱性气体 |
某同学称取9 g淀粉溶于水,测定淀粉的水解百分率。其程序如下:
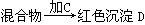
(1)各步加入的试剂为:
A________,B__________,C__________。
(2)加入A溶液而不加入B溶液是否可以________(填“可以”或“不可以”),其理由是
________________________________________________________________________。
(3)若析出1.44 g红色沉淀,淀粉的水解率是__________。